Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз
солей слабых кислот и сильных основанийСтатьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Статьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Гидролиз
солей слабых кислот и сильных оснований Гидролиз
солей слабых кислот и сильных основанийСтраница 2
Из выражения (12) видно, что увеличение концентрации соли СМА приводит к уменьшению степени гидролиза. Разбавление раствора увеличивает степень гидролиза.
Подставив в уравнение (12) значения Кг из выражения (8), получим
a »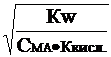 . (13)
. (13)
Сравнение степени гидролиза растворов двух солей одинаковой концентрации дает
a1 »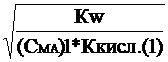 ; a2»
; a2»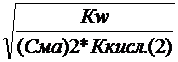 ; и
; и
![]() =
=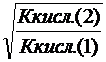 , (14)
, (14)
так как (С МА) 1 = (С МА) 2
Степень гидролиза обратно пропорциональна корню квадратному из константы диссоциации слабой кислоты.
Используя выражение (10), можно записать
Сон+ * Сон - = Кw; Сон+ = ![]() =
= ![]()
Подставив сюда ![]() из выражения (13), получим
из выражения (13), получим
Сн+= 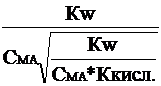 =
= 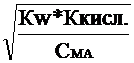 ;
;
После логарифмирования и перемены знаков
lg Сн+ = - ½ lg Кw - ½ lg Ккисл. + ½ lg Сма.
Но - lg Сн + = рН; подобные же обозначения можно употребить и для логарифмов констант равновесия.
Тогда
рН= ½ рКw + ½ рКкисл. + ½ lgСМА. (15)
Из выражения (15) видно, что рН растворов солей слабых кислот и сильных оснований растет с уменьшением константы диссоциации слабой кислоты и с ростом общей концентрации соли. Другими словами, щелочность раствора растет с уменьшением Ккисл. И с ростом СМА.
Смотрите также
Введение.
В настоящее
время в резиновой промышленности применяют широкий спектр каучуков, однако
большую часть промышленного потребления составляют натуральный и синтетический
полиизопрены. До сих пор натура ...
Атомно-абсорбционный анализ
Многие тяжелые металлы, такие как железо, медь, цинк,
молибден, участвуют в биологических процессах и в определенных количествах
являются необходимыми для функционирования растений, животных ...


