Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические свойства производных углеводородов.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Органические соединения. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Органические соединения. / Химические свойства производных углеводородов. Химические свойства производных углеводородов.
а) Получение альдегидов путем окисления спиртов. Налить в пробирку 1-3 мл раствора K2Сr2O7. 2 мл разбавленной серной кислоты и прибавить примерно 1 мл этилового спирта. Осторожно нагреть пробирку. Заметить слабый запах уксусного альдегида и изменение окраски раствора. Дихромат калия выполняет роль окислителя.
Реакция может быть представлена так:
![]()
Прибавить 1 мл фуксинсерной кислоты. Появляется характерное окрашивание фиолетового цвета (цветная реакция на альдегид).
б) Восстановительные свойства альдегидов. Получение серебряного зеркала.
В химический стакан налить воду (до половины его объема) и нагреть .до кипячения. Пробирку прокипятить со щелочью, промыть и влить 1 2мл 2% раствора нитрата серебра. Добавить по каплям 1Н раствор аммиака до тех пор, пока выпавший сначала осадок Ag2O полностью не растворится. При этом образуется комплексный ион![]() .
.
В раствор комплексной соли серебра прилить при помощи пипетки (осторожно по стенке) 2-3 капли раствора формальдегида (формалина) и поместить пробирку в стакан с кипящей водой. Через некоторое время стенки пробирки покроются блестящим налетом металлического серебра. Реакция идет по схеме:
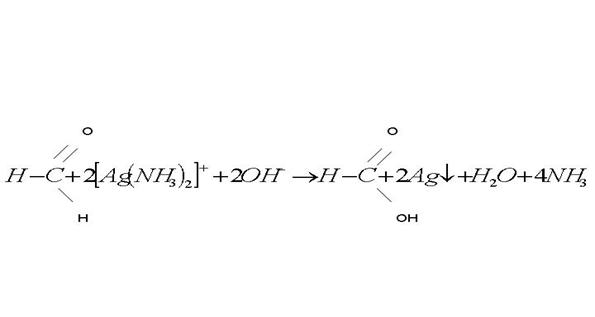
в) Получение уксусноэтилового эфира.
Налить в пробирку 1-2 мл этилового спирта и затем осторожно такой же объем концентрированной серной кислоты. Прибавить немного сухого ацетата натрия, слегка нагрейте пробирку и понюхайте образовавшееся вещество, обладающее запахом прелых яблок.
Написать уравнение реакции. Объяснить роль серной кислоты.
Смотрите также
Рабочее место руководителя
Если рассматривать рабочее место руководителя, то можно сказать, что это его рабочий кабинет, в котором он проводит большую часть работы. От того, какой это будет кабинет зависит и то, как будет работ ...
Электрофильное ароматическое замещение
Электрофильное замещение, несомненно, составляет самую
важную группу реакций ароматических соединений. Вряд ли найдется какой-нибудь
другой класс реакций, который так детально, глубоко и все ...
Основные химические законы
Когда впервые
обнаруживается, что некоторая идея объясняет или коррелирует многие факты, то
такую идею называют гипотезой. Гипотезу можно подвергнуть дальнейшей
проверке и экспериментально ...


