Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №8.Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №8. Билет №8.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора).
Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема.
![]()
Скорость реакции зависит от природы реагирующих веществ.
При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:
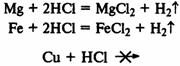
Скорость реакции увеличивается при увеличении концентрации реагирующих веществ.
Горение веществ в чистом кислороде происходит быстрее, чем в воздухе, содержание кислорода в котором составляет 21%:
![]()
Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Железные опилки быстрее реагируют с соляной кислотой, чем железные гвозди:
![]()
Скорость реакции увеличивается с увеличением темпера-
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
![]()
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет, то есть ее скорость равна 0:
![]()
Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов.
Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными.
Примеры каталитических реакций:
![]()
(реакция сильно ускоряется в присутствии МnО2).
![]()
(реакция протекает только в присутствии катализаторов — платины, оксида ванадия (V), железа и др).
Смотрите также
Зелинский Николай Дмитриевич
Есть личности, которые олицетворяют собой динамику развития общества и
определяют поступательное движение общественной жизни на многие годы. Право
стать личностью приобретается умением, буду ...


