Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электролиз.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Электролиз. Электролиз.
Цель работы - ознакомление с процессами, протекающими на растворимых и нерастворимых электродах при электролизе водных растворов электролитов.
Электролиз - это окислительно-восстановительный процесс, происходящий в растворах или расплавах электролитов под действием постоянного электрического тока. При электролизе происходит превращение электрической энергии в химическую.
Окислительно-восстановительные реакции происходят на электродах, соединенных с полюсами источника тока. Электрод, соединенный с отрицательным полюсом, является катодом, на нем идет процесс восстановления; электрод, соединенный с положительным полюсом, является анодом, на нем идет процесс окисления.
На катоде в первую очередь идет процесс, характеризующийся наиболее положительным стандартным потенциалом, т.е. в первую очередь реагируют сильные окислители. При электролизе водных растворов солей, гидроксидов на катоде может восстанавливаться катион металла или вода. Восстановление воды идет в зависимости от характера среды по уравнениям:
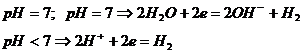
На аноде в первую очередь происходит тот окислительный процесс, который характеризуется наиболее отрицательным стандартным потенциалом.
Однако,
установлено, что при электролизе водных растворов электролитов на аноде сначала
окисляется простой анион, не содержащий атома кислорода (S2-, Cl-, I- и т.д.). Если,
анион содержит кислород (![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() и т.д.), то на аноде будет, окисляться
вода уравнениям
и т.д.), то на аноде будет, окисляться
вода уравнениям
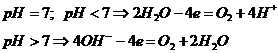
(электроды нерастворимые)
Некоторые электроды при электролизе не растворяются из-за положительного значения их равновесного потенциала или образования на их поверхности защитных пленок. Примерами таких анодов могут быть платиновые металлы, графит, титан и тантал. В этом случае происходит электролиз с нерастворимыми анодами.
Примеры:
1.
Электролиз расплава ![]() .
.
Щелочь в
расплаве диссоциирует: ![]()
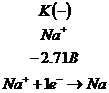
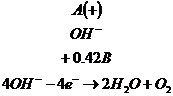
2.Электролиз
раствора ![]() .
.
Соль
диссоциирует в растворе: ![]()
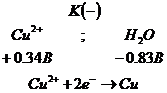
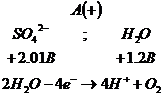
3.Электролиз
раствора ![]() .
.
Соль
диссоциирует в растворе: ![]()
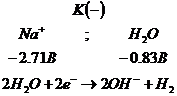
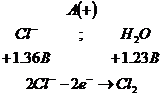
4.Электролиз
раствора сульфата меди - ![]() с медным анодом. В этом случае на катоде
протекают те же процессы, что и при нерастворимом аноде (пример 2). В анодном
процессе могут подвергаться окислению как сам медный анод, вода, ионы
с медным анодом. В этом случае на катоде
протекают те же процессы, что и при нерастворимом аноде (пример 2). В анодном
процессе могут подвергаться окислению как сам медный анод, вода, ионы ![]() по схеме:
по схеме:
![]()
Окисление воды и
ионов ![]() более
энергоемкие чем окисление медного анода, поэтому при электролизе окисляется
практически только медный анод.
более
энергоемкие чем окисление медного анода, поэтому при электролизе окисляется
практически только медный анод.
Соль
диссоциирует в растворе: ![]()
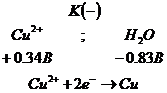
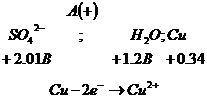
Таким образом, электролиз сульфата меди при медном аноде сводится к выделению свободной меди на катоде и постепенному растворению анода. Концентрация сульфата меди в растворе в результате этого сохраняется постоянной.
При определенных условиях в процессе электролиза на аноде, подобно меди, ведут себя и некоторые металлы, например золото, серебро, цинк, кадмий, никель, железо и др. Аноды, приготовленные из металла, превращающегося при электролизе в катионы получили название растворимых анодов.
Если потенциалы двух или нескольких электродных реакций равны, то реакции протекают на электродах одновременно. При этом прошедшее чрез электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ), называется выходом по току этого вещества,
![]()
где ![]() - количество
электричества, израсходованное на превращение i вещества,
- количество
электричества, израсходованное на превращение i вещества, ![]() - общее количество
электричества, прошедшего через раствор.
- общее количество
электричества, прошедшего через раствор.
Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея, согласно которому при прохождении через электрод одного Фарадея электричества (F = 96500Кл = 26,8) на нем окисляется или восстанавливается 1 моль эквивалентов вещества.
Экспериментальная часть.
Смотрите также
Химическое действие света. Фотография
Квантовым законам подчиняется поведение всех микрочастиц. Но
впервые квантовые свойства материи были обнаружены при исследовании излучения и
поглощения света.
Поглощается и излу ...
Кинетика химических реакций.
Цель работы - изучение
скорости химической реакции и ее зависимости от различных факторов: природы
реагирующих веществ, концентрации, температуры.
Учение о
скорости химической реакции называетс ...
Алифатические амины. Ароматические амины
Химические свойства аминов ...


