Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электронная структура атомов и
одноатомных ионов.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Электронная структура атомов и
одноатомных ионов. Электронная структура атомов и
одноатомных ионов.
Цель работы: привить навыки составления формул, выражающих электронную конфигурацию атомов и одноатомных ионов металлических и неметаллических элементов.
Согласно
квантово - механическим представлениям состояния каждого электрона в атоме
химического элемента определяется значениями четырех квантовых чисел ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Главное
квантовое число ![]() принимает
значения ряда целых чисел и характеризует уровень энергии электрона в атоме. Если
принимает
значения ряда целых чисел и характеризует уровень энергии электрона в атоме. Если
![]() , то уровень
электрона минимальный.
, то уровень
электрона минимальный.
Орбитальное
квантовое число ![]() принимает
значения в пределах от 0 до
принимает
значения в пределах от 0 до ![]() и характеризует подуровень электрона на данном
энергетическом уровне. Для обозначения энергетических подуровней используются
строчные буквы латинского алфавита:
и характеризует подуровень электрона на данном
энергетическом уровне. Для обозначения энергетических подуровней используются
строчные буквы латинского алфавита:
![]()
Используя цифровые значения n и буквенные обозначения можно составить формулу, отражающую электронную конфигурацию химического элемента.
Максимальное
число электронов в атоме, имеющих одинаковый уровень энергии определяется как ![]() . Максимальное число
электронов, имеющих одинаковый подуровень энергии на данном энергетическом
уровне определяется как
. Максимальное число
электронов, имеющих одинаковый подуровень энергии на данном энергетическом
уровне определяется как ![]() .
.
Каждый
энергетический подуровень делится на квантовые ячейки, количество которых
связано с магнитным квантовым числом ![]() , принимающим значения от -1 до +1,
включая ноль.
, принимающим значения от -1 до +1,
включая ноль.
Например,
на энергетическом подуровне Р электроны могут быть трех состояниях (в трех
квантовых ячейках) так как при ![]()
![]() .
.
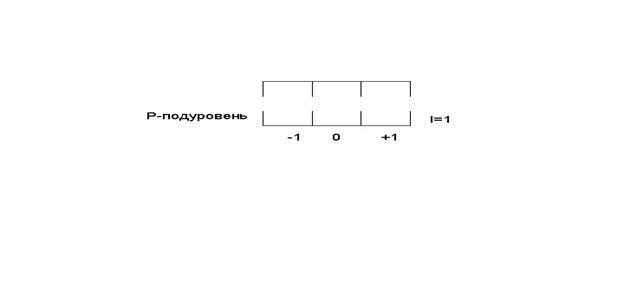
Квантовая ячейка
- графическое изображение атомной орбитали, т.е. состояния электронов в атоме,
характеризующегося определенными значениями трех квантовых чисел ![]() ,
, ![]() ,
, ![]() .
.
В каждой
квантовой ячейке может быть не более двух электронов, отличающихся друг от
друга значением спинового квантового числа (![]() и
и ![]() ). Электроны в квантовых ячейках принято
обозначать стрелками:
). Электроны в квантовых ячейках принято
обозначать стрелками: ![]() и
и ![]() .
.
Общее число электронов в атоме определяется порядковым, номером химического элемента в периодической системе Д. И. Менделеева.
Элементы, со сходной электронной конфигурацией атомов называют электронными аналогами. Так, например, электронными аналогами являются азот и фосфор;
![]()
Электронные аналоги располагаются в периодической системе Д. И. Менделеева в одной подгруппе.
Экспериментальная часть.
Смотрите также
Автоматизированная система для исследования кинетики быстрых химических реакций
...
Концентрирование карбамида
Карбамид (мочевина) СО(NH2)2 представляет
собой амид карбаминовой кислоты.
Карбамид выпускается в виде гранул или
кристаллов. В данном производстве карбамид выпускается в виде ...
Происхождение ископаемых углей
Практически невозможно установить точную дату,
но десятки тысяч лет назад человек, впервые познакомился с углём, стал
постоянно соприкасаться с ним. Так, археологами найдены доисторические
...


