Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расщепление через диастереомерыДипломы, курсовые и прочее / Оптическая изомерия / Дипломы, курсовые и прочее / Оптическая изомерия / Расщепление через диастереомеры Расщепление через диастереомеры
Этот метод до настоящего времени использовался наиболее часто. Если рацемическое соединение содержит карбоксильную группу, то можно получить соль с оптически активным основанием. Если же рацемат содержит аминогруппу, то можно получить соль с оптически активной кислотой. Допустим, что оптически активный реагент (в данном случае основание или кислота) имеет (S) - конфигурацию. Тогда образующиеся соли будут смесью (R) - и (S) - диастереомеров, и в отличие от энантиомеров их свойства будут уже различаться.
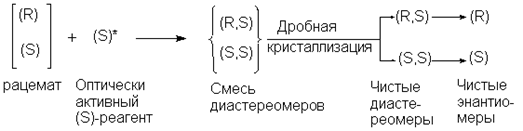
На практике чаще всего применяют кристаллизацию, используют различие в растворимости двух диастереомеров. В настоящее время все чаще применяют хроматографические методы. На последней стадии из соли выделяют знантиомер.
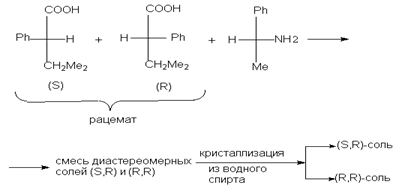
Для разделения рацемических кислотных соединений применяют природные оптически активные основания, которые называются алкалоидами, например, бруцин, эфедрин, стрихнин, хинин, цинхонин, морфин и др. После проведения разделения их регенерируют и используют снова. Однако эти вещества сильно токсичны и поэтому их стремятся заменить синтетическими оптически активными аминами, например, a - фенилэтиламином. Например, таким путем расщепляется рацемическая 3-метил-2-фенилбутановая кислота.
Для разделения рацемических основных соединений применяют оптически активные кислоты: винную, миндальную, аспарагиновую (аминоянтарную), глутаминовую (a - аминоглутаровую), камфорсульфоновую и др.
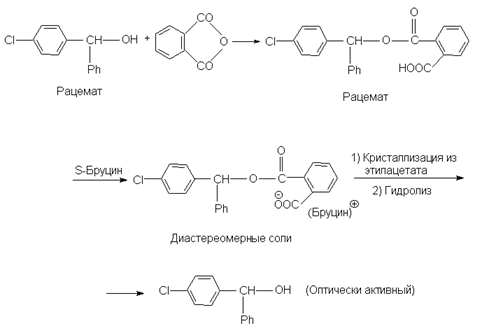
Если молекула не содержит кислотной или основной группировки, то ее можно сначала ввести, а затем после разделения на энантиомеры снять, например,
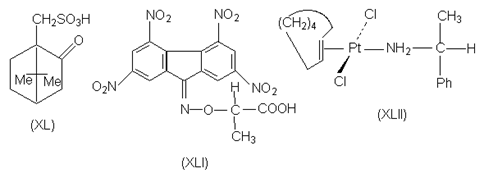
Диастереомеры могут образовываться не только в результате взаимодействий кислот и оснований Бренстеда, но также и в реакциях, в которых взаимодействуют кислоты и основания Льюиса. Так, при расщеплении ароматических соединений, в состав которых не входит ни кислотные, ни основные группировки (например, хиральных нафтиловых эфиров), может быть использована их способность образовывать p - комплексы с нитрофлуореном. Для этой цели используют реагент (XLI), в котором элекктроноакцепторные тетранитрофлуореноноксимная группа придает ей способность к комплексообразованию с электронодонорными ароматическими кольцами, а фрагмент энантиомерной молочной кислоты обеспечивает реагенту в целом оптическую активность. Другим примером является расщепление транс-циклооктена путем образования комплекса с солью двухвалентной платины (кислота Льюиса), вторым лигандом у которой является молекула (R) - a - фенилэтиламина (XLII).
Смотрите также
Фуллерены
...
Свойства элементов подгруппы VIIIB.
Цель работы: изучение
химических свойств железа, кобальта, никеля.
Первую триаду VIIIВ группы
периодической системы, состоящую из Fе, Со, Ni, очень часто называют
семейством железа. На внешнем э ...
Анализ и технологическая оценка химического производства
...


