Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температурыДипломы, курсовые и прочее / Определение термодинамических активностей компонентов бронзы БрБ2 / Дипломы, курсовые и прочее / Определение термодинамических активностей компонентов бронзы БрБ2 / Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температуры Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температурыСтраница 1
Рассмотрим низкотемпературную часть диаграммы Cu – Ni (см. рис. 1.7). Ниже линии солидуса образуется ряд непрерывных твёрдых растворов с решёткой ГЦК. Однако при температурах ниже 342°С наблюдается купол расслаивания на твёрдый раствор на основе меди (обозначим его, как α-фазу) и твёрдый раствор на основе никеля (обозначим его, как γ-фазу). Внутри купола находится смесь этих фаз.
На границе купола α-фаза находится в равновесии с γ-фазой. Это можно записать следующими уравнениями:
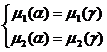 (2.4)
(2.4)
Для любого из компонентов 1 и 2 и в α- и в γ-фазе справедливо соотношение:
![]() (2.5)
(2.5)
Обе фазы имеют одинаковую структуру (ГЦК). Это можно объяснить высоким сродством меди и никеля. На диаграмме состояния (рис. 1.7) видно, что сплав плавится конгруэнтно во всём диапазоне концентраций. Более того, линии ликвидуса и солидуса расположены очень близко друг к другу, то есть плавление происходит почти в изотермических условиях, как у чистого металла. Аналогично происходит и испарение сплава.
На основании этого можно записать, что:
![]() (2.6)
(2.6)
Тогда система (2.4) перепишется в виде:
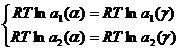 (2.7)
(2.7)
Обозначим через х мольные доли компонентов в α-фазе, а через N – мольные доли компонентов в γ-фазе, и учитывая условия нормировки их на единицу, можно систему уравнений (2.7) с учётом (1.3) и (1.6) переписать в следующем виде:
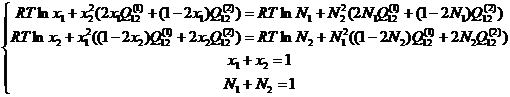 (2.8)
(2.8)
Если бы были известны мольные доли x и N при 25°С, то можно было бы с помощью (2.8) непосредственно вычислить значения Q при этой температуре. Однако при столь низкой температуре невозможно получить экспериментальных данных о координатах купола расслаивания. Дело в том, что наступление равновесия между фазами происходит, благодаря диффузии атомов, а в комнатных условиях она протекала бы экстремально долго (несколько сотен лет). Поэтому необходимо изучить температурную зависимость энергий смешения и экстраполировать её на уровень комнатных температур.
Если T=const и известны все x и N, то система уравнений (2.8) линейна относительна параметров Q и может быть решена аналитически.
Обозначим ![]() . Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
. Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
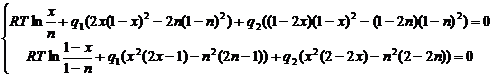 (2.9)
(2.9)
Выразим ![]() из первого уравнения системы (2.9):
из первого уравнения системы (2.9):
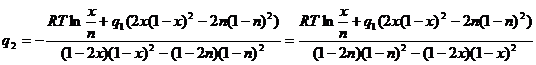 (2.10)
(2.10)
Подставим (2.10) во второе уравнение системы (2.9):
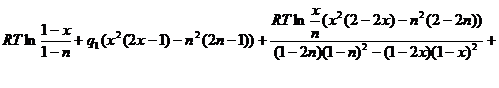
![]() (2.11)
(2.11)
Теперь можно выразить в явном виде величину ![]() :
:
Смотрите также
Специфичность фермента амилазы
Одним из фундаментальных понятий, как биологии, так и химии является понятие «фермент».Изучение ферментов имеет большое значение для любой области химической, пищевой и фармацевтической промышленн ...
Берилл: общая характеристика
Главная
цель курсовой работы – освоить методы статистической обработки больших массивов
данных с помощью программ кафедры.
Частная задача – определить
степень однородности материала, выд ...
Определение константы скорости реакции k по первым 3-м опытам
Из вида кинетического уравнения следует, что его единственным параметром
является константа скорости реакции k. Для
определения значения константы скорости воспользуемся статистическим методом
регр ...


