Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние рН на окислительно-восстановительные свойства и
направление ОВРДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Влияние рН на окислительно-восстановительные свойства и
направление ОВР Влияние рН на окислительно-восстановительные свойства и
направление ОВРСтраница 3
Используют также подход, при котором атомам С в молекуле приписывают различные степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функциональные производные можно расположить в порядке возрастания их степени окисления. Так, насыщенные углеводороды относят к нулевой группе (приблизительная степень окисления — 4), R2C=CR2, ROH, RCl и RNH2 - к первой (- 2), RCCR, R2CO и R2CCl2 - ко второй (0), RCOOH, RCCCl, RCONH2 иRССl3 - к третьей (+2), RCN, CCl4 и СО2 - к четвертой (+4). Тогда окисление - процесс, при котором соединение переходит в более высокую категорию, а восстановление - обратный процесс.
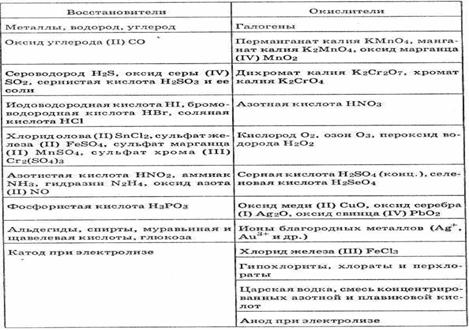
Механизмы окислительно-восстановительных реакций весьма разнообразны; реакции могут протекать как по гетеролитическому, так и по гомолитическому механизму. Во многих случаях начальная стадия реакции - процесс одноэлектронного переноса. Окисление обычно протекает по положениям с наибольшей электронной плотностью, восстановление - по положениям, где электронная плотность минимальна. В органической химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т.е. способностью действовать избирательно на определенные функциональные группы), а также получать продукты в требуемой степени окисления. Например, борогид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладают, например, комплекс CrО3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С—С, а также SeO2, окисляющий кетоны и альдегиды до б-дикарбонильных соединений.
Селективность окислительно-восстановительных реакций может быть обеспечена и в каталитических процессах; например, в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщенных углеводородов (см. Гидрирование). Электрохимическое восстановление СО2 до СО в водной среде в присутствии никелевого комплекса 1,4,8,11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких потенциалах и одновременно подавлять электролиз воды с образованием Н2. Эта реакция имеет ключевое значение для превращения СО2 через СО в разнообразные органические вещества.
Каталитические окислительно-восстановительные реакции (ОВР) играют важную роль в промышленности, например:
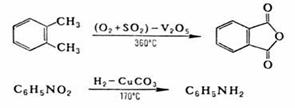
окислительно-восстановительные реакции (ОВР) широко распространены в природе и используются в технике. В основе жизни лежат окислительно-восстановительные реакции (ОВР), происходящие при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают основную часть энергопотребления человечества за счет сжигания органического топлива. Получение металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях.
Смотрите также
Окислительно-восстановительные
реакции.
Цель работы - ознакомление
с окислительно-восстановительными свойствами металлов, неметаллов и их
соединений, освоение методики составления уравнений
окислительно-восстановительных процессов.
Р ...
Жидкие кристаллы
Некоторое время
тому назад необычной популярностью в США пользовалась новинка ювелирного
производства, получившая название “перстень настроения”. За год было продано 5 0 миллионов таких ...


