Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Механизм электролитической диссоциации веществДипломы, курсовые и прочее / Химические реакции и системы / Дипломы, курсовые и прочее / Химические реакции и системы / Механизм электролитической диссоциации веществ Механизм электролитической диссоциации веществ
Рассмотрим механизм электролитической диссоциации на примере диссоциации хлорида натрия NaCl в водном растворе.
Молекулы воды полярны, они представляют собой диполи: на одном конце диполя δˉ (частичный отрицательный заряд), на другом – δ⁺ (частичный положительный заряд). При контакте кристалла NaCl с водным раствором, водородные связи между молекулами воды, находящимися вблизи кристалла, разрушаются. Диполи воды ориентируются своими полюсами относительно ионов на поверхности кристалла: отрицательным полюсом диполя – к катионам натрия, положительным полюсом диполя – к анионам хлора. Происходит процесс соединения ионов соли с молекулами воды – гидратация ионов. Молекулы воды, притягивающиеся к ионам растворяемой соли, во много раз ослабляют притяжение ионов друг к другу. Постепенно гидратированные ионы разъединяются (рис. 1).
Гидратированные ионы
– это ионы, химически связанные с молекулами воды.
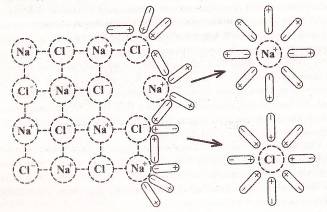 рис. 1.
рис. 1.
Одним из важных факторов. Обуславливающих возможность диссоциации электролитов в водных растворах, является высокая диэлектрическая проницаемость воды. В ходе диссоциации ионных связей энергия затрачивается, а в ходе гидратации – выделяется. Если энергия гидратации с избытком компенсирует затраты энергии диссоциации ионных связей, то растворение таких электролитов – экзотермический процесс. Если энергия гидратации не полностью компенсирует затраты энергии диссоциации ионных связей, растворение таких электролитов будет эндотермическим процессом.
Электролитическая диссоциация электролитов с ковалентной полярной связью включает в себя еще и процесс поляризации полярной молекулы. Рассмотрим схему данного процесса на примере электролитической диссоциации молекул хлороводорода в воде (рис. 2.).
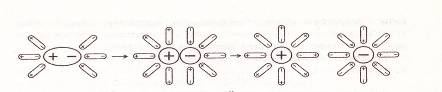 рис. 2.
рис. 2.
При растворении хлороводорода в воде диполи воды ориентируются относительно диполя НС1. Под действием диполей воды происходит поляризации связи Н-С1, в результате которой общая электронная пара полностью смещается к атомной частице хлора. Связь Н-С1 диссоциирует, и образуются гидратированные ионы. Ионы Н⁺ взаимодействуют с молекулами воды с образованием иона гидроксония Н3О⁺.
Смотрите также
Бензимидазол, его производные, их свойства и синтез трихлорбензимидазола
...
Заключение
При написании работы
был изучен метод потенциометрического титрования. В результате можно выделить несколько
основных преимуществ данного метода титрования перед методом кислотно-основного
титрован ...
Физико-химические свойства йода и его соединений
Йод
открыт французским химиком Куртуа в 1811 году, он относится к VII группе
периодической системы Д.И. Менделеева. Порядковый номер элемента - 53. В
природе он находится в виде стабильного ...


