Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
АминыСтатьи и работы по химии / Статьи и работы по химии / Амины АминыСтраница 1
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
![]()
![]()
![]()
![]()
Метанамин Этанамин N-Метилэтанамин N-Этилэтанамин
(метиламин) (этиламин) (метилэтиламин) (диэтиламин)
![]()
![]()
![]()
N,N-Диэтилэтанамин 2-Аминоэтанол 3-Аминопропановая
триэтиламин) (этаноламин) кислота



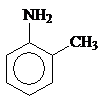
Циклогексанамин Бензоламин N-Метилбензоламин 2-Метилбензоламин
(циклогексиламин) (анилин) (N-метиланилин) (о-толуидин)
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза- для обозачения количества атомов азота.
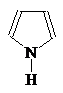
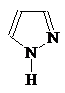
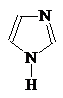
1-Азациклопета- 1,2-Диазациклопета- 1,3-Диазациклопета-
2,4-диен 2,4-диен 2,4-диен
Основность аминов
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Основные свойства аминов (Kb = 10-4) обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон. Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
![]() (22)
(22)
Метиламмонийхлорид
Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Все простейшие алифатические амины, взаимодействуя с водой, генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
![]()
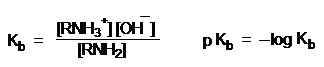
Сравнивать основность аминов можно и по значениям pKa сопряженных им кислот – аммониевых ионов.
![]()
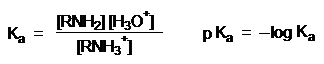
pKa + pKb = 14
Чем выше основность амина, тем сильнее он удерживает протон в аммониевом катионе RNH3+ и наоборот.
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +I-эффектом.
Нуклеофильность и основность аминов изменяются, как правило, симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности. В качестве примера можно привести основность метиламинов. По силе основности они располагаются в следующий ряд:
(СH3)2NH > СH3NH2 > (СH3)3N >> NH3 ![]()
![]()
![]()
pKb 3,28 3,36 4,30 4,74 9,42 13,00 13,20
pKa 10,72 10,64 9,70 9,26 4,58 1,00 0,80
Влияние пространственного фактора на основность и на нуклеофильность аминов наглядно демонстрируется сравнением свойств некоторых вторичных аминов.
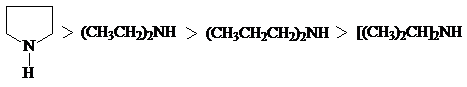
Анилин и другие ароматические амины являются слабыми основаниями.
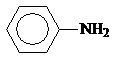
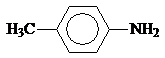
рKb 3,36 9,42 8,92
Это может быть объяснено делокализацией неподеленных электронов:
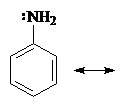



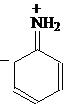
Смотрите также
Епловые эффекты химических реакций
...
Физико-химические свойства нефти, газа, воды и их смесей
...
Амины жирного ряда (алифатические амины)
Изомерия в ряду алифатических аминов связана с изомерией
углеводородного радикала и количеством заместителей у атома азота.
Многие амины имеют тривиальные названия. По рациональной
номенклатуре н ...


