Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
АминыСтатьи и работы по химии / Статьи и работы по химии / Амины АминыСтраница 2
Ион метиламмония
Как и аммиак, в водных растворах амины проявляют свойства оснований. В их растворах появляются гидроксид-ионы за счет образования алкиламониевых оснований:
C2H5NH2 + H2O === [C2H5NH3]+ + OH-
Щелочную реакцию растворов аминов можно обнаружить при помощи индикаторов.
Амины горят на воздухе с выделением CO2, азота и воды, например:
4(C2H5)2NH + 27O2 --- 16CO2 + 2N2 + 22H2O
Первичные, вторичные и третичные амины можно различить, используя азотную кислоту HNO2. при взаимодействии этой кислоты с первичными аминами образуется спирт и выделяется азот:
CH3 – NH2 + HNO2 --- CH3 – OH + N2 +H2O
Вторичные амины дают азотистой кислотой нитрозосоединения, которые имеют характерный запах:
CH3 – NH2 – CH3 + HNO2 --- (CH3)2 – N==NO+H2O
Третичные амины не реагируют азотистой кислотой.
Анилин
C6
H5
NH2
является важнейшим ароматическим амином. Он представляет собой бесцветную маслянистую жидкость, которая кипит при температуре 184,4 0 С.
Анилин был впервые получен в XIX в. русским химиком-органиком Н. Н. Зининым, который использовал реакцию восстановления нитробензола сульфидом аммония (NH4)2S. В промышленности анилин получают каталитическим гидрированием нитробензола с использованием медного катализатора:
C6H5 – NO2 + 3H2 -cu-- C6H5 – NH2 + 2H2O
Старый способ восстановления нитробензола, который потерял промышленное значение, заключается в использовании в качестве восстановителя железа в присутствии кислоты.
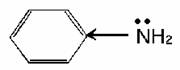 По химическим свойствам анилин во многом аналогичен предельным аминам, однако по сравнению с ними является более слабым основанием, что обусловлено влиянием бензольного кольца. Свободная электронная пора атома азота, с наличием которой связаны основные свойства, частично втягивается в П – электронную систему бензольного кольца:
По химическим свойствам анилин во многом аналогичен предельным аминам, однако по сравнению с ними является более слабым основанием, что обусловлено влиянием бензольного кольца. Свободная электронная пора атома азота, с наличием которой связаны основные свойства, частично втягивается в П – электронную систему бензольного кольца:
Уменьшение электронной плотности на атоме азота снижает основные свойства анилина. Анилин образует соли лишь с сильными кислотами. Например, с хлороводородной кислотой он образует хлорид фениламмония:
C6H5NH2 + HCl --- [C6H5NH3]Cl
Азотная кислота образует с анилином диазосоединения:
C6H5 – NH2 + NaNO2 +2HCl --- [C6H5 – N+==N]Cl- + NaCl + 2H2O
Диазосоединения, особенно ароматические. Имеют большое значение в синтезе органических красителей.
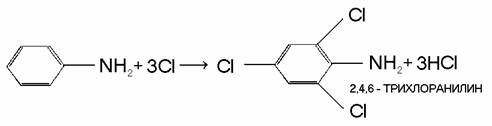
Некоторые особые свойства анилина обусловлены наличием в его молекуле ароматического ядра. Так, анилин легко взаимодействует в растворах с хлором и бромом, при этом происходит замещение атомов водорода в бензольном ядре, находящихся в орто- и пара-положенияхк аминогруппе:
 |
Анилин сульфируется при нагревании с серной кислотой, при этом образуется сульфаниловая кислота:
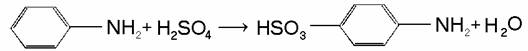 |
Смотрите также
Неорганические аниообменники, синтезированные на основе гидроксидов металлов
В представленных
статьях гидроксиды металлов рассмотрены в качестве ионитов в различных водных и
смешанных средах. Обсуждены химические и физические свойства, методы синтеза и
сорбционная а ...
Применение электрохимического осаждения хрома в полиграфии
В настоящее
время, полиграфия является одной из ведущих и развивающихся отраслей. Ежедневно
мы имеем дело с той или иной печатной продукцией: свежая пресса, всевозможные
брошюры, различные ...
Физико-химические методы определения фенола
Аналитическая химия – наука о методах определения химического состава
вещества и его структуры. Однако это определение КС представляется
исчерпывающим. Предметом аналитической химии являются ...


