Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние температуры на положение равновесияДипломы, курсовые и прочее / Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей / Дипломы, курсовые и прочее / Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей / Влияние температуры на положение равновесия Влияние температуры на положение равновесия
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия.
Запишем уравнение (I.99) в следующем виде:
![]() (I.104)
(I.104)
![]() (I.105)
(I.105)
Продифференцировав выражение (I.105) по температуре, получаем для зависимости константы равновесия от температуры уравнение (I.106) – изобару Вант-Гоффа:
![]() (I.06)
(I.06)
Рассуждая аналогичным образом, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа:
![]() (I.107)
(I.107)
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции
: ΔH° < 0 (ΔU° < 0). В этом случае, согласно (I.106, I.107), температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции
: ΔH° > 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. I.4.
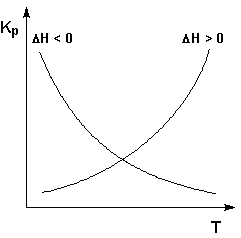
Рис. 1.4
Зависимость константы равновесия от температуры.
Действие рассмотренных нами факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии равновесия, обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.
Смотрите также
Экспериментальная часть
Реагенты
и оборудование.
Уравнение
реакции имеет вид:
Реактивы:
N-фенилантраниловая кислота (С13Н11О2N, M=213 г/моль, Тпл=179-1810С) – 3г,
серная кислота (Н2SО4, M=98.08 г/моль, Тпл=-13 ...
Приготовление основных стандартных растворов металлов с
концентрацией
1.
Средства измерений, реактивы, оборудование
Весы
лабораторные аналитические любого типа 2-го класса точности
Колбы
мерные наливные : 2-1000-2 по ГОСТ 1770
Цилиндры
мерные: 1-50 по ГОСТ ...


