Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Тепловой эффект химической реакции или изменение энтальпии
системы вследствие протекания химической реакцииДипломы, курсовые и прочее / Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей / Дипломы, курсовые и прочее / Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей / Тепловой эффект химической реакции или изменение энтальпии
системы вследствие протекания химической реакции Тепловой эффект химической реакции или изменение энтальпии
системы вследствие протекания химической реакции
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
· Реакция должна протекать либо при постоянном объёме
Qv
(изохорный процесс), либо при постоянном давлении
Q
p(изобарный процесс).
· В системе не совершается никакой работы, кроме возможной (при изобарном процессе) работы расширения.
Если реакцию проводят в стандартных условиях при Т = 298 К и Р = 101.3 кПа, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO.
Для правильного понимания понятия необходимо знать следующие понятия.
Теплоёмкость тела (обозначается с
) — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT. Единица измерения теплоёмкости в системе СИ — Дж/К.
Если же говорить про теплоёмкость произвольной системы, то ее уместно формулировать в терминах термодинамически — теплоёмкость есть отношение малого приращения количества теплоты Q к малому изменению температуры T:
![]()
Удельная теплоемкость вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус по Цельсию.
Формула расчёта удельной теплоёмкости [Дж/(кг• К)]:
![]()
Молярная теплоёмкость — это теплоёмкость одного моля вещества(количество теплоты, необходимое для нагревания тела массой 1 кг на 1 К) Часто употребляется обозначение C. Однако буквой C часто обозначается и простая теплоёмкость.
Связь с удельной теплоёмкостью:
С= M•C,
где с — удельная теплоёмкость, М — молярная масса [Дж/(К•моль)].
Средняя молярная теплоемкость - количество теплоты, необходимое для нагревания 1 моль вещества на ΔТ.
Для расчета энтальпий и энтропии вещества используют интегралы от теплоемкости:
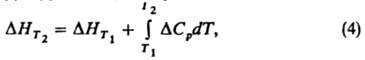
Смотрите также
Получение хлористого винила
Тема реферата «Получение хлористого винила» по дисциплине
«Органический синтез».
Хлористый винил СН2=СНС1—бесцветный газ с эфирным
запахом, температура кипения — 12,5°С, температура плавл ...
Алюминий
АЛЮМИНИЙ (лат. Aluminium; от "alumen" —
квасцы), Al, химический элемент III группы периодической системы, атомный номер
13, атомная масса 26,98154.
...
Химические свойства и область применения полиэтилентерефталата
Полиэтилентерефталат
(ПЭТФ, ПЭТ)- термопластик, наиболее распространённый
представитель класса полиэфиров, известен под разными фирменными названиями:
полиэфир, лавсан или полиэстер.
Пла ...


