Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Приближения квазистационарности и квазиравновесияДипломы, курсовые и прочее / Формально–кинетический анализ гипотез / Дипломы, курсовые и прочее / Формально–кинетический анализ гипотез / Приближения квазистационарности и квазиравновесия Приближения квазистационарности и квазиравновесияСтраница 1
При выводе кинетических уравнений часто используют различные допущения о соотношениях скоростей стадий, поскольку скорости элементарных стадий могут сильно различаться по величине. Например, скорости стадий адсорбции и химических превращений на поверхности катализатора. Важное допущение – о наличии медленных и быстрых стадий. Быстрые обратимые стадии являются квазиравновесными (РЕ – preequilibrium), а допущение о наличии таких стадий – приближением квазиравновесия. В закрытых системах особенно для каталитических реакций используют допущение о квазистационарности концентраций интермедиатов (SS – steady - state, допущение Боденштейна). Критерии применимости этих допущений рассмотрены в учебном пособии О.Н. Тёмкина, К.Ю. Одинцова и Л.Г. Брука “Приближения квазистационарности и квазиравновесия в химической кинетике”, М., МИТХТ, 2001г. Здесь приведем условия реализации различных приближений для простой схемы:
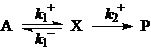 (24)
(24)
Необходимым и достаточным условием реализации приближения Боденштейна (SS) является условие СХ << СА (ΣСXi << CA). Из этого условия следует и условие
![]() (25)
(25)
которое реализуется при ![]() Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE).
Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE).
Для одномаршрутных механизмов единственную медленную стадию (все остальные квазиравновесные) называют лимитирующей стадией. Критерием условия квазиравновесия для механизма (24) является соотношение (26)
![]() (26)
(26)
Из анализа соотношений констант k1, k-1 и k2, приводящих к ε1<<1 и ε2<<1, сделан вывод, что при значительном различии ki (не менее, чем в 10 раз) имеется всего 6 вариантов соотношений констант и по 4 случая реализации режимов SS (ε1<<1) и РЕ (ε2<<1).
Таблица 1. Соотношения констант скорости и режимы протекания процесса (24).
|
№ варианта |
Соотношения ki |
|
|
Режим |
Лимитирующая стадия |
|
I |
k2>>k1>>k-1 |
<<1 |
>>1 |
SS |
1 |
|
II |
k2>>k-1>>k1 |
<<1 |
>>1 |
SS |
1 |
|
III |
k1>>k2>>k-1 |
>>1 |
<<1 |
PE * |
2 |
|
IV |
k1>>k-1>>k2 |
>>1 |
<<1 |
PE |
2 |
|
V |
k-1>>k2>>k1 |
<<1 |
<<1 |
SS, PE |
2 |
|
VI |
k-1>>k1>>k2 |
<<1 |
<<1 |
SS, PE |
2 |
Смотрите также
Определение ионов алюминия и меди (II) в сточной воде
Вода-источник
жизни, ничто живое на земле не может обойтись без нее, поэтому ее анализ имеет
важное значение. В сточных водах содержится большее количество разнообразных
органических, неорг ...
Изучение растворимости бензоата свинца в различных растворителях
Знание
растворимости какого-либо продукта изучаемого взаимодействия, в частности в нашем
случае бензоата свинца, имеет большое значение при решении различных практических
задач [1]. Наприме ...
Заключение
В
заключение несколько слов о галогенах как об элементах в клетках нашего
организма.
Фтор
постоянно входит в состав животных и растительных тканей; микроэлементов. В
виде неорганических соедин ...


