Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сорбция
из водных растворовДипломы, курсовые и прочее / Физико-химические основы адсорбционной очистки воды от органических веществ / Дипломы, курсовые и прочее / Физико-химические основы адсорбционной очистки воды от органических веществ / Сорбция
из водных растворов Сорбция
из водных растворовСтраница 2
Основы термодинамики адсорбции из растворов впервые сформулировал Гиббс более 100 лет назад. Им было введено понятия избыточной адсорбции ![]() , т.е. избыточного содержания поглощаемого вещества в адсорбированной фазе по сравнению с его содержанием в растворе. Величина избыточной (гиббсовской) адсорбции легко определима по формуле
, т.е. избыточного содержания поглощаемого вещества в адсорбированной фазе по сравнению с его содержанием в растворе. Величина избыточной (гиббсовской) адсорбции легко определима по формуле
![]() (3)
(3)
где С0 и Ск – концентрация вещества в растворе до и после опыта; V – объем раствора; m – навеска сорбента.
Термодинамический подход к решению проблемы сорбции является наиболее общим и позволяет оценивать сорбируемость молекул по значению максимальной работы переноса вещества из раствора на поверхность сорбента. Поскольку при сорбции вещества из воды происходит уменьшение свободной энергии системы ![]() , Когановский предложил использовать эту величину для прогнозирования эффективности извлечения растворенных соединений из воды. Константа равновесия при сорбции из разбавленных растворов
, Когановский предложил использовать эту величину для прогнозирования эффективности извлечения растворенных соединений из воды. Константа равновесия при сорбции из разбавленных растворов ![]() связана с
связана с ![]() зависимостью вида
зависимостью вида ![]() , из которой следует, что чем больше
, из которой следует, что чем больше ![]() , тем лучше сорбируется вещество.
, тем лучше сорбируется вещество.
Идею о возможности применения теории объемного заполнения микропор для описания сорбции из жидкой фазы выдвинули Эльтеков и Стадник. Эта идея использует представления об отсутствии влияния физического состояния сорбата в объемной фазе на сорбционный потенциал в микропорах углей и отсутствии ассоциативных, ионных и водородных связей между молекулами сорбируемого вещества и воды, а также внутри сорбата. Эта теория применима для расчета сорбции из очень разбавленных растворов ограничено растворимых веществ: уравнение изотермы сорбции на микропористых АУ в данном случае принимает вид:
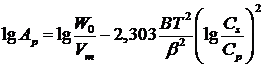 (4)
(4)
Здесь W0 – предельный объем микропор сорбента; Vm – мольный объем сорбата; ![]() – структурно-энергетическая константа;
– структурно-энергетическая константа; ![]() – растворимость соединения в воде при данной температуре;
– растворимость соединения в воде при данной температуре; ![]() – равновесная концентрация в воде.
– равновесная концентрация в воде.
Обобщая данные о сорбируемости на АУ низкомолекулярных органических соединений, можно сделать вывод, что менее других сорбируются структурно простые вещества в ионной форме, лучше – в молекулярной. Сорбируемость органических веществ возрастает в ряду:
гликоли < спирты < кетоны < сложные эфиры < альдегиды <
< недиссоциированные кислоты < ароматические соединения.
Вода, сорбируясь на участках окисленной поверхности АУ, препятствует сорбции на них неполярных алифатических соединений. Сорбируемость органических веществ возрастает с увеличением длины углеродной цепи (если она не ограничена размером пор сорбента), причем для гомологов, согласно правилу Траубе, на величину, кратную изменению длины углеродной цепи.
Способность к сорбции возрастает с ростом молекулярной массы органических веществ, особенно выше 30 000. Аналогична и зависимость при росте мицеллярной массы коллоидов. Присутствие в воде неорганических солей, способствующих укрупнению ассоциатов молекул красителей и гуматов, приводит к их более полному сорбционному выделению.
Специфическими загрязнениями сточных вод заводов СК являются неокисляемые биохимическими путем лейканол и трилон Б. Первый обладает свойствами ПАВ и присутствует в воде в виде отдельных молекул и ассоциатов, что и определяет особенность сорбции его из воды, а именно: при 20–30ºС отдельные молекулы и ассоциаты малых размеров сорбируются на ГАУ, а крупные ассоциаты способны лишь к дальнейшему укрупнению и коагуляции. Поэтому сорбционная емкость ГАУ зависит от начальной концентрации лейканола в воде, так как пропорционально росту ![]() увеличивается и доля крупных ассоциатов лейканола.
увеличивается и доля крупных ассоциатов лейканола.
Смотрите также
Кинетика химических реакций.
Цель работы - изучение
скорости химической реакции и ее зависимости от различных факторов: природы
реагирующих веществ, концентрации, температуры.
Учение о
скорости химической реакции называетс ...
Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ
базируется на химическом составе – наиболее простой и постоянной во
времени характеристике. Химический состав вещества показывает, какие элементы
присутствуют в ...
Использование озона
Озон -
высокоэффективное и универсальное окисляющее вещество, которое используется в
обработке воды в целях дезинфекции, удаления марганца и железа, улучшения
вкуса, устранения цвета и запа ...


