Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетика химических реакций.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Кинетика химических реакций. Кинетика химических реакций.
Цель работы - изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
Учение о скорости химической реакции называется химической кинетикой. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени.
![]()
Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
Зависимость скорости химической реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для уравнения реакции записанной в общем виде:
![]()
закон действия масс может быть записан:
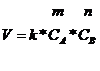
Для конкретной
реакции ![]() закон
действия масс может быть записан:
закон
действия масс может быть записан:
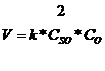
где ![]() - скорость химической
реакции;
- скорость химической
реакции; ![]() -
константа скорости;
-
константа скорости; ![]() -
концентрации реагирующих веществ.
-
концентрации реагирующих веществ.
Система является гомогенной.
Особенность гетерогенных процессов заключается в том, что они, протекают на границе раздела фаз, т.е. на поверхности раздела между фазами. Поэтому скорость химических реакций в гетерогенных системах при постоянной температуре зависит не только от концентрации вещества, но и от площади поверхности раздела.
Так для реакции:
![]()
закон действия масс имеет вид:
![]()
где ![]() - константа скорости;
- константа скорости; ![]() - концентрация
кислорода;
- концентрация
кислорода; ![]() -
площадь поверхности раздела между фазами.
-
площадь поверхности раздела между фазами.
С ростом температуры скорость химической реакции резко возрастает. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
![]()
![]()
где
![]() - скорости
реакций при
- скорости
реакций при ![]() и
и
![]() ;
; ![]() - температурный
коэффициент, показывающий во сколько раз увеличивается скорость реакции при
повышении температуры на 10°С.
- температурный
коэффициент, показывающий во сколько раз увеличивается скорость реакции при
повышении температуры на 10°С.
Очевидно, для того чтобы произошло химическое взаимодействие, не обходимо, чтобы молекулы столкнулись. Однако лишь определенная часть общего числа соударений приводит к химическому взаимодействию. Эти ее ударения называются эффективными. Число соударений резко увеличивается с ростом температуры. Соударение будет эффективным в том случае, если суммарная энергия сталкивающихся молекул будет превышать некоторую определённую для данной системы величину.
Минимальное значение избыточной энергий, которой должны обладать молекулы, для того чтобы их соударение привело к химическому взаимодействию, называется энергией активации химической реакции. Промежуточное состояние системы, отвечающее максимуму потенциальной энергии, называется активированным комплексом.
Одним из методов ускорения химической реакции является катализ, который, осуществляется при помощи веществ (катализаторов) увеличивающих скорость химической реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению энергии активации, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Экспериментальная часть.
Смотрите также
Классификация химических элементов по Гольдшмидту. Геохимические барьеры
...
Берилл: общая характеристика
Главная
цель курсовой работы – освоить методы статистической обработки больших массивов
данных с помощью программ кафедры.
Частная задача – определить
степень однородности материала, выд ...
Азотная кислота
...


