Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Трехкомпонентные системыДипломы, курсовые и прочее / Фазовые диаграммы двойных и тройных систем / Дипломы, курсовые и прочее / Фазовые диаграммы двойных и тройных систем / Трехкомпонентные системы Трехкомпонентные системыСтраница 1
Для понимания фазовых диаграмм фундаментальное значение имеет правило фаз:
P+F=C+2
связывающее для любой точки фазовой диаграммы число сосуществующих фаз, число компонентов системы и число степеней свободы, к которым относятся переменные величины - температура, давление и состав. Для двухкомпонентной системы P + F = 4. При постоянном давлении число степеней свободы уменьшается на единицу. Тогда для одной фазы возможны не более двух степеней свободы. Таким образом, фазовая диаграмма может быть представлена в двух координатах. При наличии двух фаз F= 1, поэтому в двухфазной области варьировать можно только или температуру, или концентрацию.
В трехкомпонентной системе при постоянном давлении система имеет максимум 3 степени свободы, т.е. можно варьировать температуру и две концентрации. Чтобы представить фазовую диаграмму на плоскости, можно выбрать разную стратегию в зависимости от системы и задачи, а именно зафиксировать температуру или одну из концентраций, или отношение количеств двух компонентов. Обычно определяют фазовые равновесия при постоянной температуре, используя треугольники Гиббса. Здесь вершины представляют три чистых компонента, а боковые стороны треугольника - три двухкомпонентные системы. Внутри треугольника присутствуют все три компонента и их количества считываются, как указано на рисунке. Чтобы проиллюстрировать влияние температуры на фазовое поведение, представляют множество изотермических треугольников в виде треугольной призмы.
Две трехкомпонентные фазовые диаграммы показаны на рис. Первая из них - это фазовая диаграмма системы, состоящей из воды и смеси ионного ПАВ с одним гидрофобным радикалом и слабополярного дифильного спирта в воде. На фазовой диаграмме представлены шесть различных фаз: две фазы изотропных растворов, три жидкокристаллические фазы и твердое ПАВ. В бинарной смеси с водой данное ПАВ образует только мицеллярную и гексагональную фазы. Введение деканола вызывает фазовый переход с возникновением ламелярной фазы, а при более высоких концентрациях спирта формируются обращенные структуры: обращенные гексагональная и мицеллярная фазы. Кроме однофазных областей возникает большое число двухфазных и трехфазных областей, в которых сосуществуют различные фазы.
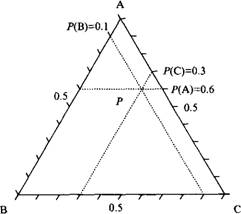
Фазовая диаграмма системы из трех компонентов А, В и С при постоянной температуре представлена треугольником Гиббса. Количество различных компонентов в точке P определяется расстоянием до противоположной стороны. Образец в точке P содержит 60% компонента А, 10% компонента В и 30% компонента С
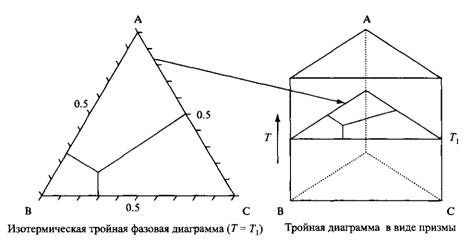
Трехмерное представление фазовой диаграммы тройной системы, отражающее влияние дополнительной степени свободы - температуры.
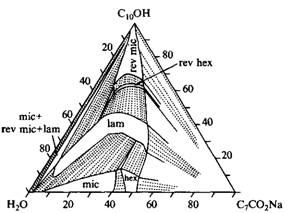
Фазовая диаграмма тройной системы, состоящей из октаноата натрия, деканола и воды при 25°С. Видно, что в системе образуются два изотропных раствора и три жидкокристаллических фазы.
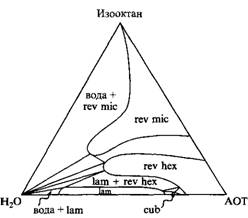
Тройная фазовая диаграмма: система состоит из анионного ПАВ с двумя неполярными "хвостами", изооктана и воды. Фазовые равновесия определены при 25°С. Наблюдаются две фазы изотропных растворов: вода и обращенная мицеллярная фаза, а также три жидкокристаллические фазы
Тройная фазовая диаграмма выглядит совершенно по-другому. Здесь представлено ионное ПАВ с двумя гидрофобными радикалами, которое в смеси с водой дает протяженную ламелярную фазу, а также биконтинуальную кубическую фазу и обращенную гексагональную фазу. Растворимость этого ПАВ в воде очень мала. При добавлении масла происходит фазовый переход ламелярной фазы в обращенную гексагональную фазу и затем в обращенную мицеллярную фазу.
Последовательность образования фаз с изменением концентрации ПАВ или при добавлении менее полярного компонента обычно следует простому ряду, установленному Фонтеллем. В зависимости от системы, температуры и других факторов образуется меньшее или большее число фаз. Например, в случае ПАВ с одним "хвостом" обычно реализуются структуры от зеркальной плоскости влево, а в случае двухцепочечного ПАВ - вправо.
Фазовая диаграмма характерна для смеси катионного и анионного ПАВ. На этой диаграмме появляются новые особенности, а именно области стабильных дисперсий везикул. В таких системах для стехиометрических смесей наблюдается выпадение твердых кристаллов. Кроме того, имеются области ламелярных и везикулярных фаз, образующиеся при избытке одного из ПАВ.
Смотрите также
Характеристика химического элемента №16 (Сера)
...
Антибиотики
Антибиотики, вырабатываемые микроорганизмами химические вещества, которые способны тормозить рост и вызывать гибель бактерий и других микробов. Противомикробное действие антибиотиков имеет избирательн ...
Тиофан
Тиолан может быть окислен в
сульфоноксид (сульфан) или в тиоландиоксид (сульфолан)
Упр.12. Промышленный синтез тиофена
осуществляется пропусканием ...


