Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Процессы, механизмы и кинетические модели в синтетической химииУчим химию / Учим химию / Процессы, механизмы и кинетические модели в синтетической химии Процессы, механизмы и кинетические модели в синтетической химииСтраница 3
Скорость реакции описывается уравнением
![]()
где FMo = 1 + KГПЭБ[ГПЭБ] + KМФК[МФК] + KОП[ОП] + KH2O[H2O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения, процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3H6 приводит к ОП.
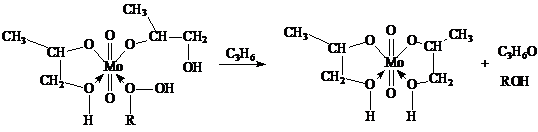
Окисление спиртов. Окисление (или окислительное дегидрирование) спиртов на металлических и окисных катализаторах до альдегидов и кетонов является важным промышленным процессом.
Рассмотрим подробнее процесс окисления метанола до формальдегида
![]()
В промышленности реализованы два варианты процесса окисления:
на оксидах MoO3-Fe2O3 (и др. оксидных катализаторах) процесс протекает в кинетической области при 300 – 350оС и 15-кратном избытке воздуха по отношению к метанолу. При этом достигаются 100% превращение спирта, высокая селективность и синтез безметанольного формальдегида, необходимого для процессов его полимеризации.
На серебряных катализаторах (мелкокристаллическое серебро, Ag/пемза, Ag/a-Al2O3 и др.) процесс протекает в адиабатическом режиме в тонком слое катализатора (8 – 10 см) во внешнедиффузионной области. Количество подаваемого кислорода ~0.9 от стехиометрии.
И основная реакция, и побочная реакция
![]()
– экзотермические процессы. Эндотермический процесс дегидрирования, который имеет место в условиях процесса
![]()
не компенсируют большого количества выделяющегося тепла. Поэтому при низких температурах (220 – 250оС) процесс протекает в кинетическом режиме, однако при больших нагрузках по спирту и небольшом количестве воздуха процесс не удерживается в изотермическом режиме, и начинается быстрый подъем температуры, обусловленный плохим отводом тепла и повышением температуры зерна катализатора Тз. Повышение Тз вызывает экспоненциальный рост скорости, рост количества выделяющегося тепла qподв (ккал/(л·час)) и еще больший рост Тз, который останавливается в новом стационарном состоянии при высоком градиенте Тз – Tf (Tf – температура газа), обеспечивающем равенство отводимого и подводимого тепла qподв @ qотв. Таким образом:
в области низких температур Тз @ Tf, qподв @ qотв, процесс протекает в кинетической области (область i);
при повышении Тз возникает неустойчивый режим (область n);
при Тз > Tf режим адиабатический (qподв @ qотв), внешнедиффузионная область, режим "зажигания", работает тонкий слой катализатора (область k).
Температуру адиабатического разогрева можно оценить по уравнениям
![]() ;
; ![]() ,
,
Смотрите также
Обезжелезивание воды
Данное исследование
проводилось в рамках школьного химико-биологического проекта «Многоликое железо».
Проект реализуется в течение учебного
года силами учащихся десятых и одиннадцатых кла ...
Получение, свойства и применение амидо-аммониевой соли малеопимаровой кислоты на основе малеинизированной канифоли
Республика Беларусь
располагает обширной сырьевой базой для развития лесохимической промышленности.
Одним из видов такого сырья является канифоль, которую получают из живицы путем
отгонки с ...
Обмен углеводов в организме животного
Углеводы, класс
органических веществ, которые характеризуются тем, что при одной альдегидной
или кетонной группе имеют несколько спиртовых групп (альдегидополиспирты или
кетополиспирты)
...


