Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Мольный изобарно-изотермический потенциал реакции полиме-
ризацииУчим химию / Определение термодинамических параметров реакции полимеризации тетрафторэтилена / Учим химию / Определение термодинамических параметров реакции полимеризации тетрафторэтилена / Мольный изобарно-изотермический потенциал реакции полиме-
ризации Мольный изобарно-изотермический потенциал реакции полиме-
ризацииСтраница 1
![]() гг = -178000+64,2·Т – (-164000+19,2·Т) = -14000 + 45·Т,
гг = -178000+64,2·Т – (-164000+19,2·Т) = -14000 + 45·Т,
а с учетом эмпирической поправки для перехода мономера из газообразного состояния в кристаллический полимер:
![]() гк = -14000 + 45·Т – 4000 + 7,5·Т = -18000 + 52,5·Т [кал/(моль·К)].
гк = -14000 + 45·Т – 4000 + 7,5·Т = -18000 + 52,5·Т [кал/(моль·К)].
При 298 К:
![]() гк (298)= -18000 + 52,5·298 = -2355 кал/моль = -9867,45 Дж/моль;
гк (298)= -18000 + 52,5·298 = -2355 кал/моль = -9867,45 Дж/моль;
Тепловой эффект реакции:
Qр-ии= -∆Н0 = 18000 кал/моль = 75,42 кДж/моль.
∆S0 гк = 52,5 кал/моль·К= 219,98 Дж/моль·К.
Таким образом, реакция является экзотермической.
![]() .
.
Предельная температура полимеризации:
ТПР = ![]() .
.
2.
Выберем температурный интервал и рассчитаем изменение энергии Гиббса, логарифм константы равновесия реакции полимеризации для построения графиков зависимости этих величин от температуры:
Изменение теплоемкости в реакции полимеризации определим как разность между теплоемкостью полимера и теплоемкостью мономера:
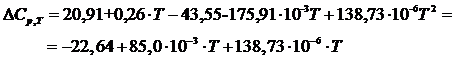
Энтальпию реакции полимеризации можно определить из уравнения Кирхгофа:
![]() .
.
Тогда, после интегрирования:
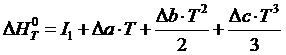 ,
,
где постоянную интегрирования![]() можно определить, подставив в приведенное выше уравнение Т = 298 К,
можно определить, подставив в приведенное выше уравнение Т = 298 К, ![]() Дж/моль:
Дж/моль:
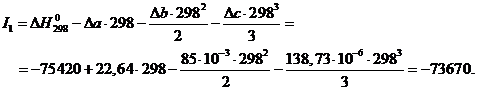
Тогда получим зависимость:
![]() .
.
Поскольку зависимость энергии Гиббса от температуры определяется следующим образом:
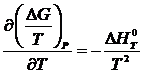 ,
,
то после интегрирования можно записать:
![]() ,
,
откуда постоянную интегрирова- ния I2 можно определить, подставив ![]() ,
, ![]() Дж/моль:
Дж/моль:
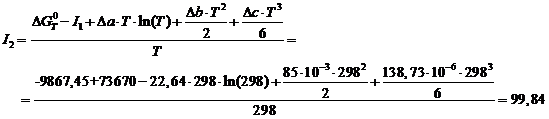
Тогда температурная зависимость энергии Гиббса:
![]()
Значение ![]() может быть вычислено по уравнению:
может быть вычислено по уравнению:
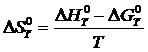 .
.
Логарифм константы скорости равен:
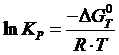 .
.
Рассчитаем ∆Н0 , ∆S0, ∆G0, и lnKp для разных температур. Полученные значения сведем в нижеследующую таблицу:
|
Температура, К |
∆Н0 , кДж/моль |
∆S0 , Дж/моль·К |
∆G0 , кДж/моль |
lnKp |
Kp |
|
270 |
-75774,34 |
-221,22 |
-16044,52 |
7,15 |
1270,90 |
|
280 |
-75662,07 |
-220,81 |
-13834,31 |
5,94 |
380,99 |
|
290 |
-75533,52 |
-220,36 |
-11628,39 |
4,82 |
124,33 |
|
300 |
-75388,43 |
-219,87 |
-9427,19 |
3,78 |
43,80 |
|
310 |
-75226,51 |
-219,34 |
-7231,11 |
2,81 |
16,54 |
|
320 |
-75047,50 |
-218,77 |
-5040,52 |
1,89 |
6,65 |
|
330 |
-74851,10 |
-218,17 |
-2855,79 |
1,04 |
2,83 |
|
380 |
-73598,74 |
-214,65 |
7967,95 |
-2,52 |
8,03·10-2 |
|
480 |
-69631,06 |
-205,47 |
28995,90 |
-7,27 |
6,99·10-4 |
|
580 |
-63481,57 |
-193,90 |
48983,08 |
-10,16 |
3,88·10-5 |
|
680 |
-54872,82 |
-180,27 |
67707,93 |
-11,98 |
6,29·10-6 |
Смотрите также
Токсические химические элементы. Химизм действия
Число
публикаций о токсичности неорганических соединений весьма велико. Наиболее
интенсивно изучаются соединения переходных элементов (тяжелых металлов) в связи
с их непрерывно расширяющимс ...
Азотная кислота
...
Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Проблема очистки воды для хозяйственно - питьевых нужд от
токсикантов, в частности, от соединений тяжелых металлов, является весьма
актуальной природоохранной проблемой в Тульском регионе, в ...


