Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Концентрация растворовОткрытая химия / Растворы / Открытая химия / Растворы / Концентрация растворов Концентрация растворовСтраница 1
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации: l Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
| |
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A. l Объемная доля растворенного вещества σ (B) выражается в долях единицы или объемных процентах:
 |
где Vi – объем компонента раствора, V (B) – объем растворенного вещества B. Объемные проценты называют градусами*). *) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm. l Мольная доля растворенного вещества χ (B) выражается соотношением
| |
Сумма мольных долей k компонентов раствора χi равна единице ![]()
К размерным концентрациям относятся следующие концентрации: l Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.
| |
l Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
| |
где μ (B) – молярная масса B, V – объем раствора. l Молярная концентрация эквивалентов вещества B CЭ (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
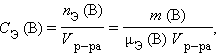 |
Смотрите также
Геометрия молекул. Теория ЛЭП. Элементы стереохимии
Специалисты
по структурному анализу считают этот раздел стереохимии одинаково важным и
увлекательным и для школьника, и для академика. У этого раздела один “большой
недостаток”.
Он
оди ...
Классы неорганических веществ. Растворы электролитов. Размеры атомов и водородная связь
...
Алкадиены. Каучук
Алкадиены, или диеновые углеводороды, — непредельные углеводороды,
содержащие в углеродной цепи молекулы две двойные связи.
...


