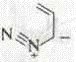Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электролитические реакции.Статьи и работы по химии / Акридон. Его получение, свойства и применение / Обзор литературы / Статьи и работы по химии / Акридон. Его получение, свойства и применение / Обзор литературы / Электролитические реакции. Электролитические реакции.Страница 1
Все рассмотренные выше примеры замыкания цикла представляют собой внутримолекулярные версии хорошо известных реакций образования σ-связей. Электроциклические реакции существенно отличаются от этих примеров прежде всего тем, что не имеют межмолекулярных аналогов. Ациклические реагенты, используемые при электроциклическом замыкании цикла, должны представлять собой полностью сопряженные π-электронные системы. В электроциклических реакциях образование σ-связи происходит в результате преобразования π-системы. Нормальное течение процесса достигается при нагревании или облучении без участия дополнительных реагентов. Электроциклические процессы равновесны, причем равновесие обычно смещено в сторону ациклических изомеров, поэтому такие реакции более применимы для раскрытия, а не для замыкания цикла.
Четыре типа электроциклических реакций, применяемых при синтезе гетероциклических соединений, схематически показаны на рис. 10. Примеры (а) и (б) иллюстрируют превращения сопряженных систем, содержащих четыре π-электрона. Замыкание цикла происходит либо в 1,3-диполе (а), либо в гетеродиене (б). Реакции (в) и (г) аналогичны (а) и (б), но цикл замыкается в шестиэлектронной π-системе. Таким образом, сопряженные π-электронные ациклические молекулы могут быть предшественниками насыщенных или частично насыщенных гетероциклов, содержащих от трех до шести атомов в цикле. Возможны также электроциклические процессы в сопряженных π-системах с числом электронов больше шести, хотя встречаются они гораздо реже.
Объяснение стереохимии реакций электроциклического замыкания и раскрытия циклов – первое достижение теории сохранения орбитальной симметрии, разработанной Вудвардом и Гофманом. Различают два типа электроциклизаций. В первом вращение р-орбиталей π-электронной системы осуществляется в одном направлении и приводит к образованию новой σ-связи, во втором – вращение происходит в разных направлениях. Первый процесс называют конротаторным (рис. 11, а), второй – дисротаторным (рис. 11, б). Правила Вудварда – Гофмана позволяют определить, какой из типов замыкания цикла предпочтителен, и тем самым предсказывают стереохимию образующегося циклического соединения. Правила определяются числом π-электронов, образующих сопряженную ациклическую систему, и тем, протекает ли процесс в основном состоянии (термическая реакция) или в первом возбужденном состоянии (фотохимическая реакция) полиена. Иллюстрация правил Вудварда – Гофмана приведена на рис. 11.
Любую электроциклическую реакцию можно осуществить как при нагревании (термически), так и при облучении (фотохимически), однако стереохимический результат в этих двух случаях будет различным. Синтетическая значимость электроциклических реакций существенно зависит от положения равновесия, поскольку это определяет, может ли циклический изомер быть выделен с удовлетворительным выходом из реакционной смеси. Положение этого равновесия может быть различным для термических и фотохимических процессов. Стереохимические различия между конротаторными и дисротаторными процессами исчезают в том случае, когда терминальное положение ациклической π-системы занимает гетероатом. Так, для большинства электроциклических процессов, приводящих к образованию гетероциклических соединений, правила Вудварда – Гофмана не имеют смысла.
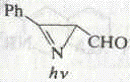
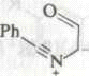
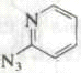
Шестиэлектронные электроциклические процессы типа (в) (рис. 10) – 1,5-биполярное замыкание цикла – более распространены. В этом случае также наблюдаются равновесные процессы замыкания и раскрытия цикла. Нестабильные 1,5-диполи обычно получают in situ и при нагревании превращают в пятичленные гетероциклы. Циклический изомер может быть выведен из равновесия при таутомерном превращении в более стабильное (часто ароматическое) соединение. Примеры 1,5-диполярного замыкания цикла приведены в табл. 5. Пример 1 демонстрирует замыкание цикла в нестабильном 1,5-диполе. В примерах 2 и 3 первоначально образующийся продукт циклизации тау-томеризуется в ароматическое соединение, что смещает равновесие в сторону циклического изомера. Реакции 4 и 5 сразу приводят к образованию ароматических гетероциклов.
Таблица 5. Примеры 1,5-диполярной циклизации.
|
Исходное соединение |
1,5-диполярный интермедиат |
Продукт циклизации |
Конечный продукт (если он отличается) |
|
1. |
|
|
_ |
|
2. Винилдиазометан не может быть выделен, но циклизуется при t>250C. |
|
|
|
|
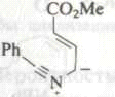
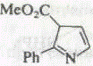
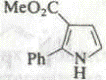
3. |
|
|
|
|
4. |
|
|
_ |
|
5. |
|
|
_ |
Смотрите также
Экспериментальная часть
Измерения
проводили по трехэлектродной схеме: рабочий электрод – стеклоуглеродный
стержень (Æ 0,7 мм), вспомогательный электрод – стеклоуглеродный тигель (V = 25 см3) и электрод сравнения – хл ...
Поверхностно-активные полимеры
Поверхностно-активные
полимеры, или полимерные ПАВ, получили широкое распространение в последние 20
лет и сейчас используются во многих технологиях. Чаще всего их применяют для
стабилизации ...
Наркотические и психотропные вещества
Злоупотребление
наркотическими средствами и незаконная торговля ими в последнее время во
многих, особенно развитых странах мира, приняли катастрофические размеры.
Официальная пресса США, Ге ...