Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Фотокатализ в очистке воды и воздухаУчим химию / Прикладная фотохимия / Учим химию / Прикладная фотохимия / Фотокатализ в очистке воды и воздуха Фотокатализ в очистке воды и воздуха
Фотокатализ - изменение скорости или возбуждение химических реакций под действием света в присутствии веществ (фотокатализаторов), которые поглощают кванты света и участвуют в химических превращениях участников реакции, многократно вступая с ними в промежуточные взаимодействия и регенерируя свой химический состав после каждого цикла таких взаимодействий. В процессах очистки воды и воздуха от органических примесей в качестве фотокатализатора используют исключительно ТiO2.
ТiO2 - полупроводниковое соединение. Электроны в полупроводниках могут находиться в двух состояниях: свободном и связанном. В первом состоянии электроны движутся по кристаллической решетке, образованной катионами Тi4+ и анионами кислорода О2-. В основном состоянии электроны связаны с каким-либо ионом кристаллической решетки и участвуют в образовании химической связи. Для перевода электрона из связанного состояния в свободное необходимо затратить энергию не менее 3,2 эВ. Эта энергия может быть доставлена квантами света с длиной волны < 390 нм. Таким образом, при поглощении света в объеме частицы ТiO2 рождаются свободный электрон и электронная вакансия (дырка). Электрон и дырка — достаточно подвижные образования, и, двигаясь в частице полупроводника, часть из них рекомбинирует, а часть выходит на поверхность и захватывается ею. Захваченные поверхностью электрон и дырка являются вполне конкретными химическими частицами. Например, электрон — это, вероятно, Тi3+ на поверхности, а дырка локализуется на решетчатом поверхностном кислороде, образуя О-. Эти частицы чрезвычайно реакционноспособны: потенциал электрона
~ -0,1 В, потенциал дырки ~ + 3 В относительно нормального водородного электрода. Таким образом, электрон может реагировать с кислородом:
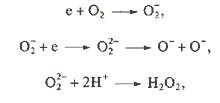
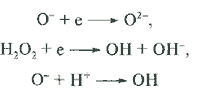
При этом образуются такие мощные окислители, как OH- и О-радикалы. В водных растворах или при низких концентрациях кислорода электрон может реагировать с молекулой Н2О, образуя гидроксид-ион и радикал Н.
Дырка реагирует либо с водой
h + H2O ![]() OH + H+
OH + H+
либо с любым адсорбированным органическим (в некоторых случаях и неорганическим) соединением:
![]()
ОН-радикал или О- также способны окислить любое органическое соединение. Таким образом, поверхность ТiO2 под светом становится сильнейшим окислителем.
Смотрите также
Особенности гель-фильтрации
...
Активность. Порядок реакций
...
Алмазы и их применение
Алмазы представляют собой интереснейший и
необыкновеннейший ресурс. Ранее, вплоть до XV века,
человечество знало лишь одну сторону этого удивительного минерала: то, что они
необык ...


