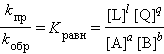Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Обратимые реакцииОткрытая химия / Химическая кинетика / Открытая химия / Химическая кинетика / Обратимые реакции Обратимые реакции
Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние. Для реакции
| |
ЗДМ для прямой реакции Vпр = kпр [A]a [B]b, для обратной реакции Vобр = kобр [L]l [Q]q. При условии Vобр = Vпр получаем
| |
При отношении ![]() получаем выражение ЗДМ для обратимой реакции
получаем выражение ЗДМ для обратимой реакции
|
Для одностадийной реакции
| |
где k1 – константа скорости прямой реакции, k–1 – константа скорости обратной реакции.
При наступлении равновесия k1 [A] = k–1 [B], следовательно ![]()
Предположим, что А может превратиться в B через промежуточную стадию образования C: ![]()
Возможен ли такой циклический процесс? Оказывается, такой циклический процесс запрещен в силу принципа детального равновесия (микроскопической обратимости), согласно которому для равновесного химического процесса всякая элементарная реакция должна идти со скоростью, в точности равной скорости реакции. То есть, в обратимой элементарной реакции прямая и обратная реакции протекают через одно и то же переходное состояние. Справедлива схема ![]()
Эти шесть констант скорости не являются независимыми, поскольку k–1 k2 k3 = k1 k–2 k–3.
Смотрите также
Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или
нескольких атомов, называются молекулами (реальными или условными
формульными единицами многоатомных веществ). Атомы в молекулах химически
связаны.
П ...
Основные
результаты и выводы
1.
При исследовании поведения молекул дизамещенного фуллерена С60 при
формировании плавающих слоев ...
Кислотно-основное, комплексно-метрическое и осадительное титрование
...