Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Получение этилена и опыты с
ним.Учим химию / Получение метана и опыты с ним / Учим химию / Получение метана и опыты с ним / Получение этилена и опыты с
ним. Получение этилена и опыты с
ним.
Оборудование и реактивы: Реакционная пробирка, газоотводная трубка, две U-образные трубки, стеклянная трубка с активированным углем (с оттянутым концом), спиртовка, штативы с лапками, кипятильники, хлоркальциевая трубка, этиловый спирт, серная концентрированная кислота, бромная вода, раствор перманганата калия, активированный уголь.
Ход работы: В сухую пробирку-реактор (рис. 2.) наливают заранее приготовленную и охлажденную смесь (6 мл) одной части спирта с тремя частями серной концентрированной кислоты. В пробирку помещают несколько кипятильников для равномерного кипения реакционной смеси. Пробирку закрепляют в штативе. Подсоединить пробирку-реактор к U-образным трубкам, используя резиновые шланги (см. рис. установки), в которых находятся раствор KMnO4 и бромная вода. Правое колено второй U-образной трубки закрывают пробкой со вставленной стеклянной трубкой, имеющей оттянутый конец. Трубка заполняется предварительно активированным углем.
Так как в процессе нагревания спирта и серной кислоты кроме этилена получаются другие вещества (SO2, диэтиловый эфир, CO2 и др.), некоторые из которых также могут обесцвечивать раствор KMnO4 и бромную воду, то на пути газовой смеси из пробирки-реактора перед первой U-образной трубкой, следует
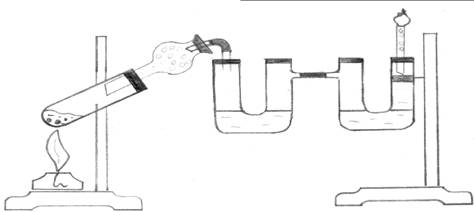
Рис. 2. Получение этилена и опыты с ним.
поместить хлоркальциевую трубку с активированным углем.
Пробирку-реактор нагреть до равномерного кипения. Наблюдать равномерное синхронное пробулькивание воздуха, а затем этилена через раствор KMnO4 и бромную воду. Окраска растворов постепенно исчезает. После полного обесцвечивания растворов поднести пламя спички или горящей лучины к трубке с оттянутым концом и поджечь этилен. Написать уравнения реакций, объяснить наблюдаемые явления.
Техника безопасности. Поджигать этилен после полного обесцвечивания раствора KMnO4 и бромной воды. Прибор должен быть герметичным, что определяется синхронным пробулькиванием газа через растворы KMnO4 и бромной воды.
Утилизация. Вследствие окисления спирта в пробирке-реакторе остается обуглившаяся смесь неопределенного состава, которую полностью переносят в емкость-нейтрализатор. В раствор, оставшийся после обесцвечивания перманганата калия, добавить немного крепкого подкисленного H2SO4 раствора KMnO4 и прокипятить. Все имеющиеся органические соединения окисляются до углекислого газа и воды:
Cх Hу Oz + KMnO4 + H2SO4 → MnSO4 + K2SO4 + CO2 + H2O.
Раствор KMnO4 использовать многократно. Утилизацию полученного MnSO4 (после отработки раствора) см.: VIII кл., тема "Галогены". В раствор, оставшийся после обесцвечивания бромной воды, добавить небольшую порцию железного порошка и несколько капель соляной кислоты средней концентрации:
Fe + HCI = FeCI2 + 2H.
Через некоторое время бромпроизводные восстановятся атомарным водородом до углеводородов и бромид-ионов, к примеру, по схеме:
C2H4Br2 + 2H = C2H6 + 2HBr (FeBr2).
Далее добавить несколько капель хлорной воды:
2FeBr2 + 3CI2 = 2FeCI3 + 2Br2.
Полученный раствор имеет желтовато-бурый цвет бромной воды, который можно использовать для определения непредельных углеводородов и демонстрации окислительных свойств брома. Далее фильтрованием отделяют железный порошок, который промывают, сушат и используют вновь.
Смотрите также
Классификация взрывов по плотности вещества, по типам химических реакций
Горение - с детства и
навсегда поражающий наше воображение феномен природы - несомненно один из важнейших
для природы и человеческой практики физико-химических процессов. Греческий миф о
Пр ...
Характеристика свойств нобелия
...
Растворы и растворители
Растворы
и растворители. Участие растворителей в кислотно-основном взаимодействии. Протеолитическая
теория кислот и оснований. Способы выражения концентрации растворов. Буферные
растворы и ...


