Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Синтез окиси этилена через
этиленхлоргидринУчим химию / Окись этилена / Учим химию / Окись этилена / Синтез окиси этилена через
этиленхлоргидрин Синтез окиси этилена через
этиленхлоргидринСтраница 1
Технологический процесс производства окиси этилена хлоргидринным способом включает три основные стадии:
1) получение этиленхлоргидрина;
2) получение окиси этилена взаимодействием этиленхлоргидрина с едкой щелочью;
3) очистку окиси этилена.
В первой стадии процесса хлор и этилен пропускают в воду. При этом хлор гидролизуется:
![]()
Таким образом, при пропускании хлора в воду получается хлорная вода, содержащая соляную кислоту, хлорноватистую кислоту и молекулярный хлор, относительное количество которого увеличивается по мере поглощения хлора водой. Если в воде растворяется малое количество хлора, он гидролизуется почти полностью, с увеличением концентрации хлора в воде степень его гидролизе уменьшается.
Образующаяся хлорноватистая кислота присоединяется к этилену, давая этнленхлоргидрин:
![]()
При пропускании этилена в хлорную воду всегда протекают одновременно две реакции: образование этиленхлоргидрина в результате взаимодействия с этиленом хлорноватистой кислоты и образование дихлорэтана при взаимодействии с этиленом растворенного (молекулярного) хлора:
![]()
Относительное количество образующегося дихлорэтана будет возрастать по мере увеличения концентрации этиленхлоргидрина в воде, так как одновременно повышается концентрация хлористого водорода, а следовательно, увеличивается количество недиссоциированного хлора, реагирующего с этиленом с образованием дихлорэтана.
Выделение высококонцентрированного этиленхлоргидрина из разбавленных растворов связано с большими трудностями. Несмотря на значительную разницу температур кипения этиленхлоргидрина (129°С) и воды разделить их обычной ректификацией невозможно, так как они образуют азеотропную смесь, содержащую 41% этиленхлоргидрина и кипящую при 98°С. Поэтому путем ректификации в лучшем случае удается отделить 41%-ный водный раствор этиленхлоргидрина. На практике во второй стадии процесса при получении окиси этилена непосредственно используют разбавленные растворы этиленхлоргидрина.
Окись этилена образуется при взаимодействии этиленхлоргидрина со щелочью:
![]()
Выход окиси этилена может значительно понизиться вследствие протекания побочной реакции – омыления этиленхлоргидрина разбавленной щелочью в этиленгликоль:
![]()
Чем ниже концентрация реагирующих компонентов, тем больше образуется этиленгликоля и тем ниже выход окиси этилена. Более благоприятные условия создаются, если в колонну, в которой проводится обработка этиленхлоргидрина щелочью, снизу вводить пар и подогревать 4 – 6%-ный раствор этиленхлоргидрина до температуры кипения азеотропной смеси этиленхлоргидрина и воды. При этом содержание этиленхлоргидрина в парах повышается до 41% и во взаимодействие со щелочью, орошающей колонну, вступает не разбавленный, а концентрированный этиленхлоргидрин. Концентрация применяемой щелочи также должна быть достаточно высокой (40%-ный раствор едкого натра или 30%-ное известковое молоко). Таким образом, реакция протекает фактически между концентрированными этиленхлоргидрином и щелочью, и образование этиленгликоля сводится к минимуму.
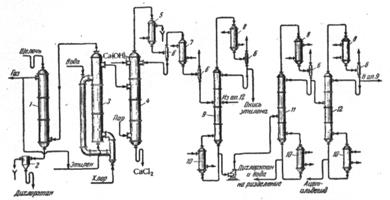
Рис. 2.1. Схема производства окиси этилена непрерывным методом через этиленхлоргидрин.
Смотрите также
Фазовые диаграммы двойных и тройных систем
...
Поверхностно-активные полимеры
Поверхностно-активные
полимеры, или полимерные ПАВ, получили широкое распространение в последние 20
лет и сейчас используются во многих технологиях. Чаще всего их применяют для
стабилизации ...
Бензимидазол, его производные, их свойства и синтез трихлорбензимидазола
...


