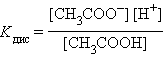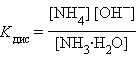Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Константы диссоциации кислот и
основанийОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Константы диссоциации кислот и
оснований Константы диссоциации кислот и
оснований
Для слабых электролитов, к каковым относятся некоторые кислоты и основания, константа равновесия реакции диссоциации получила название константы диссоциации.
|
Реакция |
Константа диссоциации |
|
|
|
|
|
|
Поскольку эти константы – очень малые величины ![]() = 1,86∙10–5,
= 1,86∙10–5, ![]() = 1,77∙10–5), их выражают через отрицательный десятичный логарифм: – lg Kдисс = pKдисс. Тогда pK приведенных выше констант составят pKк = 4,730 и pKосн = 4,752.
= 1,77∙10–5), их выражают через отрицательный десятичный логарифм: – lg Kдисс = pKдисс. Тогда pK приведенных выше констант составят pKк = 4,730 и pKосн = 4,752.
Многоосновные кислоты и многокислотные основания характеризуются соответствующим числом ступенчатых констант диссоциации:
| |
|
| |
|
| |
|
| |
|
| |
|
Смотрите также
Определение фенола методом броматометрического титрования
...
Характеристика элементов ниобия и тантала
По размеру, как атомов, так и
ионов ниобий и тантал близки друг к другу, поэтому их свойства как элементов
целесообразно рассмотреть одновременно. Одинаковые объемы атомов объясняются
тем, что член ...
Выводы
Методом линейной
циклической вольтамперометрии исследовано совместное восстановление ионов
гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и
платиновом электродах.
...