Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Принцип Ле ШательеОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Принцип Ле Шателье Принцип Ле Шателье
При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1. Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
2. Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
3. Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
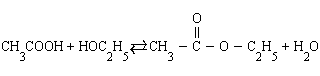 |
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
Смотрите также
Норборненна-2,5-диен и его свойства
Норборненна- 2,5-диен (НБД) или бицикло
[2.2.1] гептан-2,5-диен и его производные приобретают все большее значение в
различных сферах человеческой деятельности, появляются все новые области ...
Введение
Многие
основные представления, касающиеся природы окраски минералов, явления люминесценции,
оптического поглощения в ультрафиолетовой и видимой областях спектрального
диапазона, взаимосвязанные про ...
Определение степени полимеризации целлюлозы
Молекулярная масса целлюлозы является одной из
важнейших ее характеристик и в значительной степени определяет как области
практического использования различных препаратов целлюлозы, так и
ф ...


