Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Энергия ГиббсаОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Энергия Гиббса Энергия ГиббсаСтраница 2
Зависимость ΔH от температуры выражается соотношением ΔHT = ΔH° + ΔCp · ΔT, где ΔCp – изменение теплоемкости системы. Если в интервале температур 298 К – T реагенты не претерпевают фазовых превращений, то ΔCp = 0, и для расчетов можно пользоваться значениями ΔH°. информация здесь
Энтропия индивидуальных веществ всегда больше нуля и составляет от десятков до сотен Дж∙моль–1K–1 (табл. 4.1). Знак ΔG определяет направление реального процесса. Однако для оценки осуществимости процесса обычно пользуются значениями стандартной энергии Гиббса ΔG°. Величина ΔG° не может использоваться в качестве критерия вероятности в эндотермических процессах со значительным возрастанием энтропии (фазовые переходы, реакции термического разложнения с образованием газообразных веществ и др.). Такие процессы могут быть осуществлены за счет энтропийного фактора при условии
|
|
|
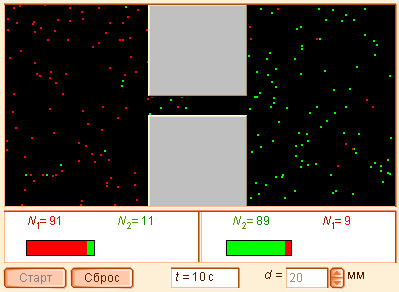
Модель 4.11. Диффузия газов |
Смотрите также
Расчет насадочной ректификационной колонны непрерывного действия по разделению смеси хлороформ-бензол
Задание на проектирование по теме «ректификация»
Разделяемая смесь
...
Определение термодинамических активностей компонентов бронзы БрБ2
Цель данной
работы – расчёт термодинамических активностей компонентов бериллиевой бронзы
БрБ2. Это является первым шагом на пути к изучению термодинамических свойств
этой бронзы, построению ...