Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Энергия ГиббсаОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Энергия Гиббса Энергия ГиббсаСтраница 1
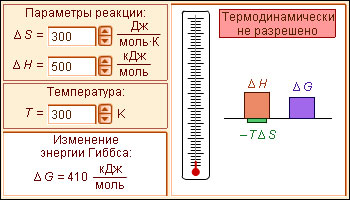
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
|
(4.2) |
|
|
|
Модель 4.10. Энергия Гиббса |
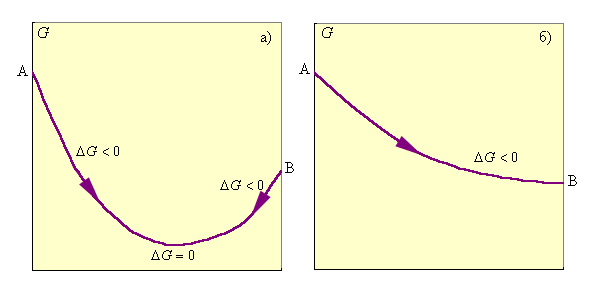
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен (рис. 4.4).
 |
|
Рисунок 4.4 Изменение энергии Гиббса: а – обратимый процесс; б – необратимый процесс |
Записав уравнение (4.2) в виде ΔH = ΔG + T ΔS, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» энергию ΔS · T. Энергия Гиббса, представляющая собой убыль изобарного (P = const) потенциала, равна максимальной полезной работе. Уменьшаясь с течением химического процесса, ΔG достигает минимума в момент равновесия (ΔG = 0). Второе слагаемое ΔS · T (энтропийный фактор) представляет ту часть энергии системы, которая при данной температуре не может быть превращена в работу. Эта связанная энергия способна лишь рассеиваться в окружающую среду в виде тепла (рост хаотичности системы).
Итак, в химических процессах одновременно изменяются энергетический запас системы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не совершающая работу энергия).
Анализ уравнения (4.2) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T). l Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре. l Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях. l В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Проиллюстрируем эти четыре случая соответствующими реакциями:
|
1. |
ΔH < 0ΔS > 0ΔG < 0 |
C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O(реакция возможна при любой температуре) |
|
2. |
ΔH > 0ΔS < 0ΔG > 0 |
реакция невозможна |
|
3. |
ΔH < 0ΔS < 0ΔG > 0, ΔG < 0 |
N2 + 3H2 = 2NH3 (возможна при низкой температуре) |
|
4. |
ΔH > 0ΔS > 0ΔG > 0, ΔG < 0 |
N2O4(г) = 2NO2(г) (возможна при высокой температуре). |
Для оценки знака ΔG реакции важно знать величины ΔH и ΔS наиболее типичных процессов. ΔH образования сложных веществ и ΔH реакции лежат в пределах 80–800 кДж∙![]() . Энтальпия реакции сгорания
. Энтальпия реакции сгорания ![]() всегда отрицательна и составляет тысячи кДж∙
всегда отрицательна и составляет тысячи кДж∙. Энтальпии фазовых переходов обычно меньше энтальпий образования и химической реакции Δ
– десятки кДж∙
, Δ
и Δ
равны 5–25 кДж∙
.
Смотрите также
Электрофильное ароматическое замещение
Электрофильное замещение, несомненно, составляет самую
важную группу реакций ароматических соединений. Вряд ли найдется какой-нибудь
другой класс реакций, который так детально, глубоко и все ...
Развитие хроматографии
С необходимостью
разделения и анализа смеси веществ приходится сталкиваться не только химику, но
и многим другим специалистам.
В мощном арсенале
химических и физико-химических методов ра ...
Химические свойства ароматических аминов
Ароматические амины имеют менее выраженный основный характер, чем
алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина ...