Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Фазовые равновесия в системе MgS-Y2S3.
Фазовое равновесие в системе Mg-S.Учим химию / Фазовые равновесия в системе MgS-Y2S3 / Учим химию / Фазовые равновесия в системе MgS-Y2S3 / Фазовые равновесия в системе MgS-Y2S3.
Фазовое равновесие в системе Mg-S. Фазовые равновесия в системе MgS-Y2S3.
Фазовое равновесие в системе Mg-S.
Моносульфид MgS имеет кубическую кристаллическую структуру типа NaCl. Структура MgS образуется сочетанием довольно объемных анионов серы и значительно меньших по размерам катионов металлов. Можно предполагать, что анионы серы как более крупные по размерам имеют тенденцию к регулярному расположению в элементарных ячейках довольно тесно один возле другого; они образуют при этом пустоты, в которых располагаются катионы. Каждый ион магния окружен шестью ионами серы, расположенными в вершинах правильных октаэдров. Все пустоты, в которых периодически располагаются катионы (согласно их размерам и заряду), в структуре MgS заняты и возможность образования твердого раствора по разрезу MgS-Ln2S3 маловероятна.[1]. В системе Mg-S (рис.1) образуется единственная фаза MgS. Температура плавления составляет 2270К, при которой MgS разлагается.[2]
![]()
![]()
![]()
![]()
![]()
![]()
![]()
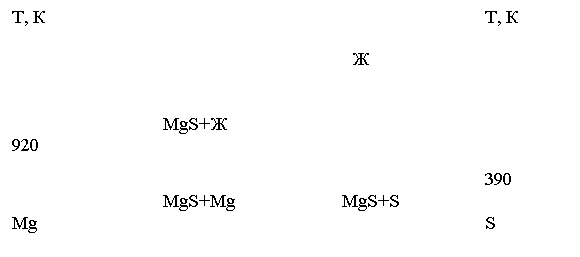 |
Свойства MgS
MgS получают:
1. Mg+S=MgS (реакция происходит в фарфоровой трубке при 8000С).
2. 2Mg + S + H2S = 2MgS + H2
3. MgO + CS2 = 2MgS + CO2 (температура 700-9000С).
4. MgO + C + S = MgS + CO
5. MgSO4 +2C = MgS + 2 CO2 (температура 9000С).
MgS представляет собой бесцветные (или розовато-красные из-за примесей) кубические кристаллы с решеткой типа NaCl (межатомные расстояния 2,89 А) и плотностью 2,79 гр/см3. Они плавятся при температуре 20000С, фосфоресцируют, вызывают красное катодное свечение, трудно растворимы в воде, реагируют с холодной водой[2]:
3MgS + 2HOH = Mg (HS)2 + 2MgO + H2S
При гидролизе MgS в теплой воде образуется окись магния и сероводород[3]:
MgS + HOH = MgO + H2S
Разбавленные кислоты, такие как HF, HCl, H2SO4, реагируют с MgS, образуя соли и H2S. Cl, Br, I энергично реагируют с нагретым выше 3000С MgS, образуя соответствующие галогениды.
Двуокись углерода под давлением 50-100 мм.рт.ст. реагирует с MgS, нагретым выше 6600С[4]:
MgS + CO2 = MgO + COS
Смотрите также
Тиофан
Тиолан может быть окислен в
сульфоноксид (сульфан) или в тиоландиоксид (сульфолан)
Упр.12. Промышленный синтез тиофена
осуществляется пропусканием ...
Фотометрическое определение благородных металлов
Фотометрические
методы определения элементов основаны на простой зависимости между
интенсивностью окраски раствора и концентрацией вещества в растворе. Для
фотометрического определения испо ...
Производство глутаминовой кислоты
Глутаминовая кислота (α-аминоглутаровая) является одной из
важнейших аминокислот растительных и животных белков. Не относится к числу
незаменимых, однако, тем не менее, служит основой д ...


