Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Соединения меди.Статьи и работы по химии / d-элементы I-ой группы и их соединения / Статьи и работы по химии / d-элементы I-ой группы и их соединения / Соединения меди. Соединения меди.Страница 2
Хлорид меди (II) получают действием НCl на СuО, Сu(ОН)2 или Сu2(ОН)2СO3. При упаривании раствора можно выделить сине-зеленые кристаллы CuCl2·2H2O. Безводную соль получают нагреванием кристаллогидрата в токе хлороводорода (обезвоживание на воздухе дает продукт, загрязненный в результате гидролиза основными солями). С хлоридами щелочных металлов CuCl2 образует хлорокупраты (II), напримерK2[CuCl4]. По cтруктуре CuCl2 – неорганический полимер, в его паре находятся цепные молекулы
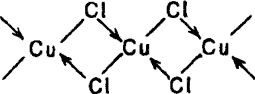
В кристаллической решетке эти цепи расположены друг над другом так, что каждый атом Сu окружает 6 атомов Cl, образующих искаженный октаэдр. Известно много других солей Сu+2. На практике часто применяется синий CuSO4·5H2O – медный купорос. В кристаллической решетке этого соединения ион Сu2+ окружен 4 молекулами H2O, центры которых образуют квадрат, одна молекула H2O является мостиковой и она связана водородными связями с ионом SO42– и одной из молекул H2O, находящихся около иона Сu2+. При нагревании медный купорос обезвоживается. Безводный сульфат CuSO4 бесцветен. Нитрат меди (II) образует кристаллогидрат Cu(NO3)2·6H2O синего цвета. Нагреванием этого соединения нельзя получить безводный нитрат, так как происходит разложение:
2Cu(NO3)2 ® 2CuO + 4NO2 + O2 Безводный нитрат меди (II) (сине-зеленая окраска) получают взаимодействием меди с жидким N2O4). При действии на растворы, содержащие Cu2+, карбонатов щелочных металлов образуется основной карбонат меди (зеленовато-голубой осадок):
2CuSO4 + 2Na2CO3 + H2O ® Сu2(ОН)2СO3 + 2Na2SO4 + СO2 Ионы S2– дают с Сu2+ черный осадок сульфида меди (II) CuS. Черный сульфид меди (I) Cu2S получают взаимодействием меди с серой при нагревании. Это нестехиометрическое соединение, приведенная формула приблизительно отражает его состав. Известно много комплексов, содержащих Сu2+. Так, при действии избытка водного аммиака на растворы, содержащие ионы Сu2+ образуются комплексы [Cu(NH3)4(H2O)2]2+. Сульфат тетраамминмеди (II) [Cu(NH3)4]SO4·H2O (темно-синие кристаллы) выделяется при добавлении к раствору, содержащему CuSO4 и NH3, этилового спирта, в котором данный комплекс мало растворим. Известно несколько соединений меди (III), в частности, оксид Сu2O3 (красная окраска):
2Сu(ОН)2 + 2КОН + K2S2O8 ® Сu2O3¯ + 2K2SO4 + 3H2O Сu2O3 – очень сильный окислитель. Достижения последних лет – открытие в 1986-87 гг. керамических высокотемпературных сверхпроводников, содержащих медь в степени окисления больше +2. Эти вещества сравнительно просто получают спеканием соответствующих оксидов. Одно из наиболее употребимых соединений этого типа приближенной формулы YВа2Сu3O7 переходит в сверхпроводящее состояние при ?90К, имеет решетку типа перовскита (см. рис. 3.78), в которую включены слои атомов меди. Аналогичную структуру имеют и другие подобные сверхпроводники (содержат вместо Сu таллий или висмут). Пока нет теории, показывающей связь свойств этих веществ с их химической природой.
Смотрите также
Нанотехнология. Перспективы развития
...
Фазовые равновесия
Гетерогенная
система - система,
состоящая из нескольких фаз.
Фазой называется
совокупность гомогенных (однородных) частей системы, одинаковых по составу,
химическим и физическим свойств ...
Монослой на поверхности
воды
Наряду с полностью гидрофильными и
гидрофобными молекулами существуют еще и молекулы вроде русалок – одна их часть
гидрофильная, а другая гидрофобная. [7]Такие молекулы получили название амфифильных ...


