Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Рассчет изменения скорости химической реакцииБиблиотека / Библиотека / Рассчет изменения скорости химической реакции Рассчет изменения скорости химической реакцииСтраница 1
Теплоты нейтрализации соляной, уксусной и масляной кислот гидроксидом натрия соответственно равны
– 55,9 кДж/моль; – 56,07 кДж/моль; – 57,74 кДж/моль. Вычислить теплоту диссоциации уксусной и масляной кислот.
Решение.
![]() (1)
(1)
Сокращенное ионное уравнение: ![]() (2)
(2)
![]() (3)
(3)
Ионное уравнение: ![]() (4)
(4)
![]()
Отнимаем уравнение 2 от уравнения 4 и получаем:
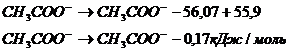
Также и с масляной кислотой:
![]()
![]()
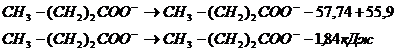
Ответ: -0,7 кДж, - 1,84 кДж.
Рассчитать изменение скорости химической реакции при повышении температуры от 293 до 373 К? Температурный коэффициент этой реакции равен 2.
Решение. Подставляем в формулу 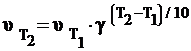
значения температур Т1 и Т2 : ![]()
Рассчитываем изменение скорости химической реакции:![]()
Ответ: ![]()
Изменение свободной энергии, сопровождающее химическую реакцию, ее связь с константой равновесия. Расчет теплового эффекта реакции.
Изменение свободной энергии Гиббса![]() , или изменение изобарно-изотермического потенциала - это та максимальная часть энергии системы, которая в данных условиях может превратиться в полезную работу. При
, или изменение изобарно-изотермического потенциала - это та максимальная часть энергии системы, которая в данных условиях может превратиться в полезную работу. При ![]() реакция протекает самопроизвольно.
реакция протекает самопроизвольно.
В соответствии с законом действующих масс для произвольной реакции
а A + b B = c C + d D (1)
уравнение скорости прямой реакции можно записать:
![]()
,
(2)
а для скорости обратной реакции
![]()
. (3)
По мере протекания реакции (1.33) слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости υ 1 и υ 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
![]()
,
(4)
откудаKc = k1 / k2 = ![]() .
.
Постоянная величина Кс, равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия.
Константа равновесия является постоянной только для данной температуры, т.е. Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции представляют собой смесь идеальных газов, то константа равновесия (Кр) выражается через парциальные давления компонентов:
Kp = ![]() . (5)
. (5)
или![]() . (6)
. (6)
Из уравнения (6) следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (1) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения D G и этой реакции можно получить из уравнения:
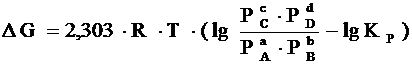 , (7)
, (7)
где Р А, Р В, Р С, Р D – парциальные давления исходных веществ и продуктов реакции.
Уравнение (7) называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения G и F реакции, определить ее направление при различных концентрациях исходных веществ.
Смотрите также
Химические реакции и системы
Химия – наука о веществах и их
превращениях друг в друга.
Вещество – вид материи,
имеющий определенный состав (природу и число составляющих его частиц), строение
(пространственное распол ...
Вторичные процессы и их роль при анодном оксидировании алюминия и его сплавов
...


