Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Константы σ и ρОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Константы σ и ρ Константы σ и ρ
Ионизация бензойных кислот облегчается электроноакцепторными заместителями и затрудняется электронодонорными заместителями. Поскольку сильные кислоты имеют низкие рКа, это значит, что для акцепторных заместителей σ положительны, а для донорных заместителей отрицательны. Таким образом, знак σ противоположен знаку индуктивного и мезомерного эффектов заместителей (разд. 2.2.1): для заместителей (-I) или (-М)-типа или для заместителей, обладающих противоположно направленными индуктивным и мезомерным эффектами в случае (-I)>(+M) или (-M)>(+I) σ>0, а для заместителей (+I) или (+M)-типа σ<0. Абсолютная величина σ является мерой силы заместителя как донора или акцептора электронной пары. Для мета- и пара-Z величина σ зависит от относительных вкладов мезомерного и индуктивного эффектов, а также от вклада эффекта поля (прямого электростатического взаимодействия диполярной группы Z с диполярным реакционным центром через пространство; разд. 2.2.1). Для заместителей в орто-положении к реакционному центру большую роль играют пространственные эффекты, которые зависят не только от объема заместителя, но и от объема реакционного центра и поэтому не постоянны при переходе от одной реакции к другой. В связи с этим орто-заместители в корреляции Гаммета, как правило, не включают.
Если знаки ρ и σ одинаковы, то lg(KZ/K0)>0 и KZ>K0. Таким образом, положительный знак константы ρ показывает, что реакции способствуют электроноакцепторные заместители. Абсолютная величина ρ является мерой чувствительности данной реакции к влиянию заместителей. Для арилуксусных кислот ρ=0,49, т.е. эта реакция менее чувствительна к введению заместителей, чем диссоциация бензойных кислот (ρ=1 по определению); в случае 3-арлилпропионовых кислот ρ=0,21, т.е. чувствительность еще меньше. Эти данные вполне понятны, так как в 3-арилпропионовых кислотах заместитель Z удален на одну, а в 3-арилпропионовых кислотах - на две метиленовые группы дальше от реакционного центра, чем в бензойных кислотах. При бесконечном удалении от реакционного центра влияние заместителей вообще перестает сказываться и ρ будет равна нулю.
Отметим, что константа ρ для диссоциации бензойных кислот увеличивается при переходе от водных растворителей к этанолу, а затем к ДМФА; в диполярных апротонных растворителях она примерно одинакова:
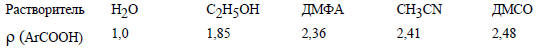
В газовой фазе наблюдаются еще более высокие значения . Это связано с уменьшением способности среды сольватировать протон.
Отрицательные значения ρ соответствуют случаям, когда реакции способствуют электронодонорные заместители. Например, в реакциях катионов арендиазония с аренсульфинатами при введении заместителей в катион наблюдается положительные значения ρ, а при введении заместителей в анион константа ρ отрицательна.
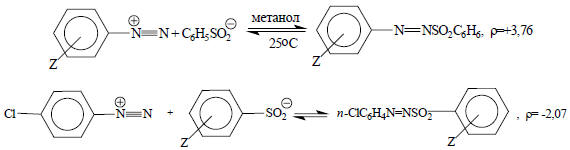
Это легко объяснить на том основании, что акцепторные заместители увеличивают силу кислоты Льюиса ArN2-, но уменьшают силу основания Льюиса ArSO2-.
Смотрите также
Приложение
Рис.1. Спектры
оптического поглощения образцов синей и прозрачной соли из Соликамска и Польши.
Рис.2. Декомпозиция спектров оптического
поглощения ка ...
Висмут и его соединения в природе
Среди элементов периодической системы висмут – последний практически не радиоактивный элемент,
И он же открывает шеренгу тяжелых элементов – естественных альфа-излучателей. Действительно, тот ...
Свойства кальция
...


