Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теоретическое обоснование принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Теоретическое обоснование принципа ЖМКО Теоретическое обоснование принципа ЖМКОСтраница 1
Первоначально принцип ЖМКО рассматривался как сугубо качественный подход, основанный лишь на рациональном объяснении ряда "повседневных наблюдений". Пирсон в своих статьях убеждал не использовать термин "теория", а рассматривать концепцию ЖМКО лишь как "полезный для химии качественный принцип". Тем не менее теоретики всегда пытались придать этому принципу больше физического смысла, и поставить его хотя бы на полуколичественную основу. Благодаря этому принцип ЖМКО в настоящее время можно описать количественно.
Для количественного описания взаимодействия между кислотой и основанием Льюиса вводятся понятия абсолютной жесткости и абсолютной электроотрицательности молекул. Смысл этих понятий пояснен на рис. 3.1. Абсолютная жесткость (G) - это величина энергетический щели между граничными МО молекул:
G=-[ε(ВЗМО)-ε(НСМО)]/2.
Абсолютная электроотрицательность молекулы (χ) характеризуется положением средней точки между уровнями НСМО и ВЗМО:
χ= -[ε(ВЗМО)+ε(НСМО)]/2.
Чем больше величина G, тем молекула "жестче". Чем больше величина χ, тем молекула более электроотрицательна.
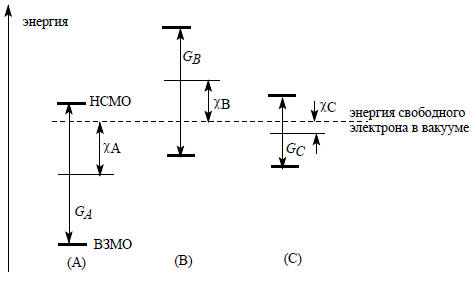
Рис. 3.1. Абсолютная жесткость и абсолютная электроотрицательность молекул. Молекула С мягче молекул А и В. Молекулы А и В имеют одинаковую жесткость, но электроотрицательность молекулы А больше, чем электроотрицательность молекулы В.
При взаимодействии кислоты А с основанием В происходит образование донорно-акцепторного комплекса АВ (реакция (3.2)). Можно полагать, что прочность комплекса АВ, т.е. сила кислотно-основного взаимодействия, будет определяться степенью переноса заряда от В к А. Степень переноса заряда (ΔN ) имеет размерность долей электрона и связана с абсолютной жесткостью и абсолютной электроотрицательностью следующим соотношением:
ΔN=(χA-χB)/GA+GB). (3.3).
Это соотношение показывание, что величина ΔN будет тем больше, чем больше разность электроотрицательностей между молекулами кислоты и основания, и тем меньше, чем больше жесткость взаимодействующих молекул кислоты и основания.
По смыслу разность электроотрицательностей представляет собой термодинамическую движущую силу переноса заряда от основания к кислоте, а сумма абсолютных жесткостей является мерой сопротивления молекул А и В переносу заряда, т.е. связана с их поляризуемостью.
В общем, образование аддукта между кислотой и основанием Льюиса зависит от трех факторов:
1) орбитального взаимодействия, которое можно в первом приближении свести к взаимодействию граничных орбиталей;
2) кулоновского взаимодействия, особенно сильного, когда реагенты имеют противоположные заряды;
3) пространственных препятствий.
При проведении реакций в растворе существует и четвертый фактор, который обобщенно называется сольватацией.
Орбитальное и кулоновское взаимодействия описываются выражением (3.3), поскольку величина G связана с энергией граничных МО, а величина χ - с зарядом молекулы (чем больше положительный заряд, тем молекула более электроотрицательна).
Влияние сольватации будет кратко рассмотрено в этом разделе ниже. Пока же мы более подробно остановимся на первых двух факторах: взаимодействии граничных орбиталей и кулоновском притяжении, и будет считать, что пространственные факторы и сольватация несущественны.
Смотрите также
Приготовление сорбентов и колонок для высокоэффективной жидкостной хроматографии
...
Огнестойкие композиции на основе полибутилентерефталата
"В химии нет отходов, есть только
неиспользованное сырье" Д. И. Менделеев.
Как известно, развитие современной техники
невозможно без исследования пластических масс, в особенност ...
Химия в сельском хозяйстве
Химизация — это одно из направлений научно-технического
прогресса, основанное на широком применении химических веществ, процессов и
методов в различных отраслях, например в сельском хозяй ...


