Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Применение принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Применение принципа ЖМКО Применение принципа ЖМКО
Органические реакции. Проиллюстрируем, каким образом данные табл. 3.1 можно использовать для предсказания положения равновесия. Метанол и метилиодид формально можно представить как продукты нейтрализации мягкой кислоты СН3+ основаниями ОН- (жесткое) и I- (мягкое). Тогда на основании принципа ЖМКО можно "предсказать", что в реакции метанола с иодоводородом равновесие должно быть сдвинуто вправо, так как при этом образуются связи, соответствующие взаимодействию "мягкий-мягкий" и "жесткий-жесткий".
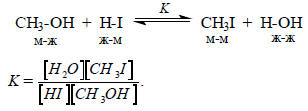
И действительно, константа равновесия очень велика: K≈109 при 25о С.
В другой приведенной ниже реакции происходит переход ацильного катиона (СН3С+=О, жесткая кислота) от мягкого основания RS- к жесткому основанию ОН-, и поэтому равновесие "должно" быть сдвинуто вправо:
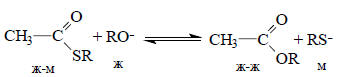
И действительно, эксперимент показывает, что тиоэфиры очень легко реагируют с водой и спиртами в слабощелочной среде.
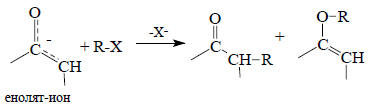
Принцип ЖМКО широко применяется в органической химии, и мы будем его использовать в последующих главах этой книги. Например, этот принцип очень полезен при описании путей реакций амбидентных нуклеофилов, каковыми являются енолят-ионы, с электрофильными агентами (гл. 17):
а также амбидентных электрофилов, например, α,β-ненасыщенных карбонильных соединений, с нуклеофилами (гл. 16):
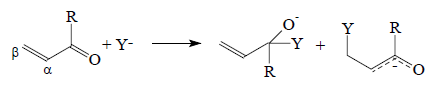
В первом случае в енолят-ионе углеродный нуклеофильный центр мягче, чем кислородный, и поэтому выход продукта алкилирования по углероду выше, если "кислотная часть" электрофила R-X (т.е. R+) является более мягкой кислотой Льюиса. Во второй реакции чем мягче нуклеофил Y-, тем выше его сродство к более мягкому электрофильному центру - β-углеродному атому, а не к более жесткому карбонилу. Поэтому для мягких нуклеофилов возрастает роль присоединения по β-атому С=С-связи (реакция Михаэля; см. гл. 16).
Симбиоз. На жесткость и мягкость донорного и акцепторного атомов в основаниях и кислотах соответственно оказывает влияние жесткость или мягкость заместителей, имеющихся в молекуле еще до образования аддукта. Этот эффект получил название "симбиоз". Суть его состоит в том, что мягкие заместители делают кислоты и основания более мягкими, жесткие заместители делают их более жесткими. Например, [Co(NH3)5F]2+ более стабилен, чем [Co(NH3)5I]2+, поскольку жесткое основание NH3 как бы увеличивает жесткость кобальта, делая его более склонным к присоединению фторида, а не иодида. С другой стороны, если аммиак заменить на мягкий лиганд CN-, то стабильность инвертируется: [Co(CN)5I]3- стабилен, а [Co(CN)5F]3- не существует.
Смотрите также
Задание
1.
Уравнение реакции
Br Br
...
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...
Cульфоксидный комплекс гидрохинона как фотоинициатор полимеризации метилметакрилата
Рассматривается
поведение сульфоксидного комплекса гидрохинона в радикальной полимеризации
метилметакрилата. Показано, что в отличии от гидрохинона такой комплекс участвует
в фотоинициирова ...


