Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Обзор литературыБиблиотека / Определение электропроводности лизина / Библиотека / Определение электропроводности лизина / Обзор литературы Обзор литературыСтраница 1
Мерой способности веществ проводить электрический ток является электрическая проводимость L – величина, обратная электрическому сопротивлению R. Так как,
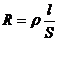
то
![]()
где ρ – удельное сопротивление, Ом*м; S – поперечное сечение, м2; 1/ρ = – удельная электрическая проводимость.
Удельная электрическая проводимость раствора электролита (Ом-1*см-1) – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 м2 и расположенными на расстоянии 1 м друг от друга.
Кривая зависимости удельной электропроводности раствора от концентрации обычно имеет максимум. Наличие максимумов кривых становится понятным, если учесть, что в разбавленных растворах сильных электролитов скорость движения ионов почти не зависит от концентрации, и электропроводность растет почти прямо пропорционально числу ионов, которое, в свою очередь, растет с концентрацией. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
Молярная электрическая проводимость раствора – мера электрической проводимости всех тонов, образующихся при диссоциации 1 моль электролита при данной концентрации. Она численно равна электрической проводимости объема V(м3) раствора заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1 м, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества. Между молярной и удельной электрическими проводимостями имеется соотношение: λ= V= /с, где λ – молярная электрическая проводимость; - удельная электрическая проводимость; V – разведение раствора, м3/моль; с – концентрация, моль/м3. С увеличением разведения молярная электрическая проводимость стремится к предельному значению![]() . Эта величина отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Величина молярной электрической проводимости бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определенному виду ионов. Рост молярной электрической проводимости с увеличением разведения для слабых электролитов может быть объяснен на основе представлений классической теории электролитической диссоциации, согласно которой с увеличением разведения степень диссоциации электролита возрастает и в пределе стремится к 1. Для сильных электролитов, диссоциирующих полностью,
. Эта величина отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Величина молярной электрической проводимости бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определенному виду ионов. Рост молярной электрической проводимости с увеличением разведения для слабых электролитов может быть объяснен на основе представлений классической теории электролитической диссоциации, согласно которой с увеличением разведения степень диссоциации электролита возрастает и в пределе стремится к 1. Для сильных электролитов, диссоциирующих полностью, ![]() Изменение молярной электрической проводимости от концентрации для сильных электролитов объясняется иначе. По теории Дебая – Онзагера снижение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано с уменьшением скоростей движения ионов. Это объясняется появлением эффектов торможения движения ионов, возникающих за счет сил электростатического взаимодействия между ионом и его ионной атмосферой.
Изменение молярной электрической проводимости от концентрации для сильных электролитов объясняется иначе. По теории Дебая – Онзагера снижение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано с уменьшением скоростей движения ионов. Это объясняется появлением эффектов торможения движения ионов, возникающих за счет сил электростатического взаимодействия между ионом и его ионной атмосферой.
Смотрите также
Йод
ИОД (лат. Iodium), I - химический элемент VII
группы периодической
системы Менделеева, относится к галогенам (в литературе
встречается также символ J); атомный номер 53, атомная масса 126, ...
Введение
Процессы ректификации являются одними из самых энергоемких
процессов химической технологии, и их эффективность часто определяет экономику
производства в целом. В ряде случаев на разделение методом р ...
Исследование свойств продуктов циклизации алициклического 1,5,9-трикетона
Алициклические
1,5,9-трикетоны – малоизученный класс соединений, хотя первые сведения о них
появились еще в 50-х годах прошлого века. Наличие нескольких реакционных
центров делают трикетоны ...


