Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали HFОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали HF Молекулярные орбитали HFСтраница 2
Главное возмущение орбитали F2px обусловлено близко расположенной по энергии орбиталью H1s, поэтому ψ2 можно изобразить в следующей форме:
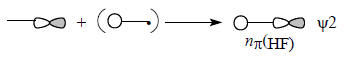
Очевидно, что ψ2 можно отождествить с третьей неподеленной парой фтора, но эта пара в определенной степени связывает атомы H и F (ср. рис. 1.17, гл. 1), и поэтому орбиталь ψ2 имеет индекс σ (nσ). Таким образом, молекула HF имеет две nπ-орбитали и одну nσ-орбиталь. Орбитали nπ чисто несвязывающие, но орбиталь nσ немного участвует в связывании, так как в области между ядрами Н и F волновые функции перекрываются в фазе. Поэтому энергия nσnπ- немного ниже энергии nπ (ср. рис. 1.17). îáùåì, äëÿ ëþáîé äâóõàòîìíîé ìîëåêóëû òèïà ÍÕ (HCl, HLi, HO, HC, HN, HB и т.д.), в которой Х - элемент второго и более низких периодов, характер соответствующих орбиталей остается одним и тем же независимо от Х. Например, метин СН («половинка ацетилена»), который может служить лигандом в некоторых комплексах переходных металлов (см. гл. 27), так же, как и HF, имеет пару вырожденных орбиталей типа nπ и три делокализованные σ-орбитали следующего вида:
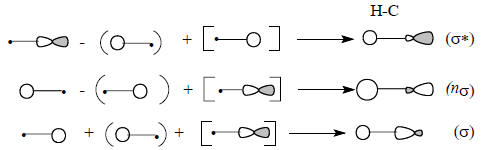
Благодаря смешиванию орбиталей C2s и С2рх фрагменты молекулярных орбиталей у атома углерода получаются асимметричными, по форме напоминающими sp-гибрид (гл. 1, разд. 1.8). Орбиталь nσ расположена в основном на атоме углерода и большая ее доля направлена в противоположную сторону от атома углерода. Это хорошо соответствует несвязывающему характеру орбитали nσ.Мы рассмотрели канонические делокализованные орбитали молекул НХ, а теперь обратимся к альтернативной картине гибридизованных орбиталей, т.е. орбиталей отдельных связей. В качестве примера возьмем молекулу СН (рис. 2.17).
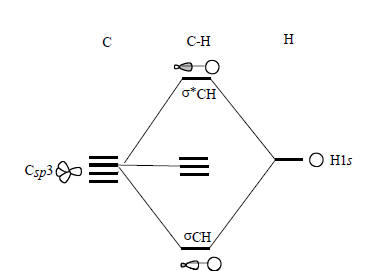 Рис. 2.17. Диаграмма взаимодействия орбиталей для СН в приближении орбиталей отдельных связей.
Рис. 2.17. Диаграмма взаимодействия орбиталей для СН в приближении орбиталей отдельных связей.
Орбитали связи СН получаются путем комбинации sp3-гибридных орбиталей атома углерода с s-орбиталью атома водорода. Одна из четырех sp3-гибридных АО взаимодействует с H1s, образуя орбитали σСН и σ*СН, а три оставшиеся гибридные орбитали становятся несвязывающими орбиталями и располагаются на углероде. Отметим, что орбитали связи СН по характеру соответствуют молекулярным орбиталям ψ1 и ψ5. Орбитали связей и молекулярные орбитали молекулы НХ коррелируют между собой следующим образом:
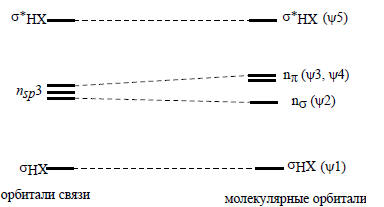
По сравнению с несвязывающими орбиталями sp3 молекулярная орбиталь nσ имеет более низкую энергию (так как электроны, занимающие ее, участвуют в связывании Н с Х), но зато орбитали py и pz получают более высокую энергию, чем sp3-гибриды. Молекулярно-орбитальные и связь-орбитальные модели молекул энергетически эквивалентны. Для молекулы HF также возможны два эквивалентных описания: через орбитали связи H-F и несвязывающие sp3-гибридные «неподеленные пары» и через делокализованные молекулярные орбитали:
Смотрите также
Современные конструкции фильтровальных аппаратов
...
Cупрамолекулярная химия
Проанализировано развитие области науки, называемой
супрамолекулярной химией. Даны основные определения и понятия этой дисциплины.
В историческом контексте рассмотрены исследования, заложивш ...
Силикагель и его применение в высокоэффективной жидкостной хроматографии
В современной промышленности и науке особое место среди сорбентов
принадлежит силикагелю, представляющему собой высушенный гель кремниевой кислоты.
По масштабам применения силикагель существ ...


