Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали HFОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали HF Молекулярные орбитали HFСтраница 1
Молекула HF образуется путем взаимного возмущения орбиталей H1s и валентных орбиталей (2s, 2p) атома фтора подходящей для взаимодействия с симметрии. Для образования связи H-F могут быть использованы только 2s и 2pх-орбитали атома фтора, так как перекрывание 2py- и 2pz-орбиталей атома фтора с 1s -орбиталью атома водорода равно нулю (см. гл. 1, разд. 1.7).
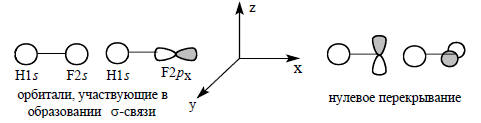
Таким образом, в образовании одной связи H-F должны участвовать три орбитали: H1s, F2s и F2pх.
Из трех невозмущенных орбиталей (АО) должны образовываться три возмущенные орбитали (МО), но связи H-F соответствуют лишь две МО: связывающая и антисвязывающая σ*. Следовательно, третья МО должна носить несвязывающий характер. Получается ситуация, аналогичная рассмотренной выше (разд. 2.4.1) при образовании несвязывающей π-МО аллильной системы.
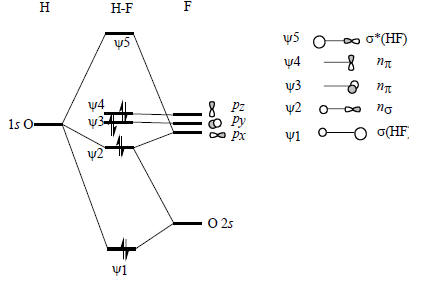 Рис. 2.16. Молекулярные орбитали HF.
Рис. 2.16. Молекулярные орбитали HF.
Диаграмма молекулярных орбиталей H-F приведена на рис. 2.16. Поскольку фтор значительно более электроотрицателен по сравнению с водородом, его валентные АО на диаграмме расположены ниже 1s-орбитали водорода. Самая нижняя связывающая МО ψ1 по энергии ближе всего к F2s-орбитали, поэтому и по форме должна быть похожей на F2s. Она образуется возмущением 2s-орбитали водорода под влиянием 1s-орбитали водорода возмущенной 2рх-орбиталью фтора:
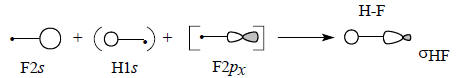
Поскольку ψ1 самая нижняя МО молекулы HF, взаимодействие трех орбиталей происходит в фазе, что отражено знаками «плюс» на приведенной схеме.Перекрывание между двумя s-орбиталями должно превышать перекрывание между s - и р-орбиталями (см. гл. 1, разд. 1.7). Это означает, что главный вклад в энергию вносит взаимодействие F2s-H1s. В первом приближении можно даже пренебречь возмущением со стороны орбитали F2рх (поэтому на схеме эта орбиталь заключена в квадратные скобки) и считать, что ψ1 образуется только из F2s и H1s. Поскольку ψ1 ближе к F2s, чем к H1s, коэффициент, с которым в нее входит F2s, должен превышать коэффициент H1s (поэтому на схеме H1s заключена в круглые скобки). Таким образом, орбиталь ψ1 должна выглядеть примерно так, как показано ниже, что полностью соответствует ее «яйцевидной» форме, полученной с помощью компьютера (см. рис. 1.17):
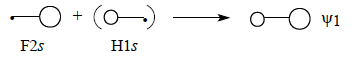
Рассуждая аналогично, можно заключить, что разрыхляющая орбиталь ψ5 в основном принадлежит водороду: Пренебрегая последним членом, получим:
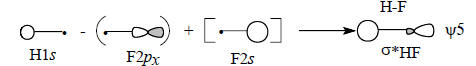
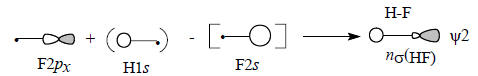
Молекула HF имеет три несвязывающие МО (рис. 2.16). Две из них - это невозмущенные 2рy- и 2рz-орбитали, которые соответствуют «неподеленным электронным парам». Третья орбиталь ψ2 - это орбиталь атома фтора, возмущенная 1s -орбиталью атома водорода с небольшим участием 2s -орбитали атома фтора:
Смотрите также
Каталитический риформинг
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели потребляют
бензины. В настоящ ...
Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Проблема очистки воды для хозяйственно - питьевых нужд от
токсикантов, в частности, от соединений тяжелых металлов, является весьма
актуальной природоохранной проблемой в Тульском регионе, в ...
Получение, свойства и применение амидо-аммониевой соли малеопимаровой кислоты на основе малеинизированной канифоли
Республика Беларусь
располагает обширной сырьевой базой для развития лесохимической промышленности.
Одним из видов такого сырья является канифоль, которую получают из живицы путем
отгонки с ...


