Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Особенности альтернантных углеводородовОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Особенности альтернантных углеводородов Особенности альтернантных углеводородовСтраница 3
При объединении двух нечетных АУ возникает большое возмущение их несвязывающих nπ-орбиталей, которые имеют равную энергию (рис. 2.11). Изменение общей энергии π-электронов (которое называется энергией делокализации, δЕπ), если пренебречь малыми возмущениями второго порядка между заполненными и пустыми орбиталями (ср. рис. 2.8,б), будет определяться изменением энергии: δЕπ= 2ε = 2CxCyβ, (2.11) где Cx и Cy -коэффициенты атомов х и y в nπ двух объединяющихся нечетных АУ.
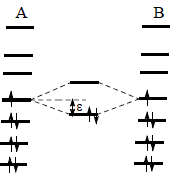 Рис. 2.11. Возмущение первого порядка между НМО двух фрагментов нечетных альтернантных углеводородов А и В.
Рис. 2.11. Возмущение первого порядка между НМО двух фрагментов нечетных альтернантных углеводородов А и В.
Два аллильных фрагмента можно объединить концом к концу - с образованием гексатриена или по обоим концам - с образованием бензола. Поскольку возмущения первого порядка аддитивны, при расчете δЕπ для образования бензола уравнение (2.11) используется дважды - для взаимодействия xy и x’y’:
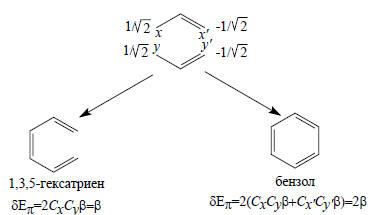
Бензол оказывается более стабильным, чем гексатриен, т.е. более стабильным, чем можно вычислить, исходя из таблицы энергий связей С-С, С=С и С-Н. Следовательно, бензол является ароматическим углеводородом (см. гл. 12).
Если аллил объединить с одиночной р-орбиталью (обозначается жирной точкой и рассматривается как крайний случай нечетного АУ), то можно прийти к бутадиену или к циклобутадиену:
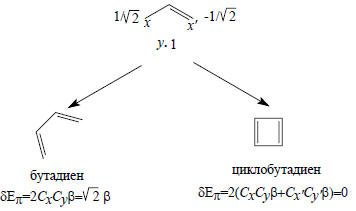
В этом случае замыкание цикла энергетически нейтрально, так как CxCy и Cx’Cy’ сокращаются. Делокализованный циклобутадиен уже не ароматичен; он антиароматичен, т.е. менее стабилен, чем его аналог с открытой цепью или предположительно вычисленный по таблице энергий связей.Поскольку при образовании циклобутадиена энергия не изменяется (δЕπ=0), аллильная nπ-орбиталь должна оставаться без изменения, и поэтому циклобутадиен должен иметь несвязывающую МО. Но циклобутадиен - это четный АУ, в котором все МО парные, и, следовательно, у него две несязывающие орбитали. Учитывая правило Хунда, можно заключить, что циклобутадиен представляет собой бирадикал (рис. 2.12), как четырех π- электронный циклопропенильный анион (рис.2.7). Энергия двух связывающих электронов циклобутадиена относительно несвязывающего уровня составляет 2×2β=4β, а соответствующая энергия открытого бутадиена (см. рис. 2.8) равна (21,62+20,62)β=4,48β, т.е. последняя система на 0,48β стабильнее (напомним, что β<0).
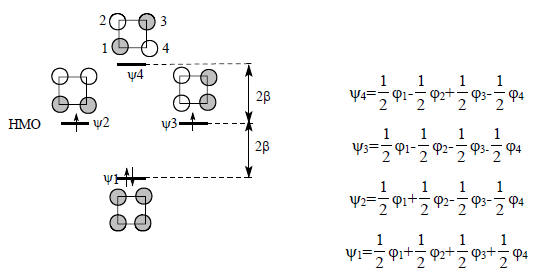 Рис. 2.12. π-Орбитали циклобутадиена. Коэффициенты рассчитаны по методу Хюккеля (все С=1/2).
Рис. 2.12. π-Орбитали циклобутадиена. Коэффициенты рассчитаны по методу Хюккеля (все С=1/2).
Энергия делокализации неальтернантных систем. Описанный выше метод можно использовать и для оценки энергии делокализации неальтернантных углеводородов. Например, фульвен можно образовать из двух аллильных фрагментов следующим образом:
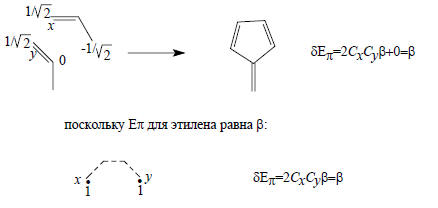
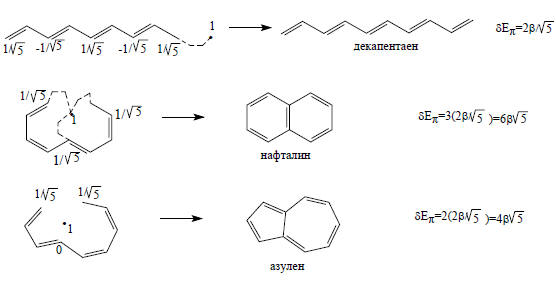
фульвен, содержащий три сопряженные двойные связи, нисколько не стабильнее этилена.С другой стороны, азулен немного стабильнее ациклического декапентаена, т.е. ароматичен, хотя его ароматичность менее выражена, чем ароматичность нафталина. Это иллюстрируется следующими расчетами:
Смотрите также
Нитрование n-нитроацетанилид
Нитрования – один
из важнейших процессов в химической промышленности. Продукты, получаемые за
счёт нитрования, являются полуфабрикатами для производства многих товаров
различных назначений ...


