Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Особенности альтернантных углеводородовОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Особенности альтернантных углеводородов Особенности альтернантных углеводородовСтраница 2
Такое распределение заряда в бензильном катионе и анионе соответствует (-М)-эффекту группы -СН2+ и (+М)-эффекту группы -СН2-.Энергия делокализации. При образовании бутадиена из двух этиленовых фрагментов (см. рис. 2.8) изменяется энергия, вследствие взаимного возмущения двух π-систем четных АУ. Это изменение энергии рассчитать не очень легко. Возмущение первого порядка между двумя полностью занятыми или двумя пустыми орбиталями не понижает энергию. Понижение энергии обусловлено относительно слабым взаимодействием второго порядка между связывающими и антисвязывающими орбиталями. В первом приближении величина этого эффекта второго порядка для линейных (ациклических) π-систем не зависит от того, какие четные АУ взаимно возмущаются, т.е. можно добавлять этиленовые фрагменты, и общая энергия каждый раз будет оставаться одной и той же. Это означает, что ациклические сопряженные полиены сильно похожи на системы с локализованными π-связями, что отражается в длинах связей. Двойные связи в ациклических полиенах имеют практически такую же длину, как и в этилене. Тем не менее «простые» (в классическом понимании) связи в полиенах заметно короче, чем в этане (1,48 Å вместо 1,54 Å). Это является следствием возмущения второго порядка. Возмущение первого порядка не сближает объединяющиеся атомы двух этиленовых фрагментов, а возмущение второго порядка их сближает, так как это сопровождается пусть небольшим, но реальным выигрышем энергии. Для всех ациклических полиенов вклад возмущения второго порядка, отражающийся в уменьшении длины «простых» связей, приблизительно один и тот же. Поэтому теплоту образования полиенов можно вычислить просто как сумму энергий отдельных связей, используя «исправленную» величину энергии «простой» связи С-С (91 вместо 82 ккал/моль как в этане). Однако, если в случае алканов использование в повседневной работе химика локализованных связей оправдано, то в случае полиенов это не так. Ациклические полиены склонны реагировать по концам π-системы.Например, бутадиен присоединяет молекулу брома не только по двойной связи, но и в положении 1,4:
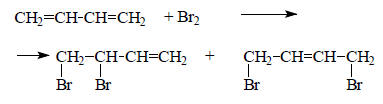
Кроме того, рис. 2.8 и 2.9 показывают, что делокализация на самом деле является существенной чертой строения этих молекул. Фактически существование молекул с делокализованными связями было понято еще много десятилетий назад, что отразилось, в частности, в теории «остаточных валентностей» Тиле. Тем не менее в случае бутадиена, гексатриена, октатетраена и т.д. влияние делокализации на общую энергию (но не на энергию отдельных орбиталей) невелико, и многие свойства таких молекул можно описать на основе модели с локализованными связями (см. гл. 7). Выявить делокализацию можно более явно, если при построении π-системы полиенов мы будем объединять два фрагмента нечетных АУ. Пусть, например, объединяются π-системы двух аллильных радикалов. Прежде всего необходимо пояснить, что подразумевается под термином «объединение π-систем». Аллильный радикал теоретически может существовать как π-радикал или как σ-радикал, в котором орбиталь, несущая неспаренный электрон, приблизительно представляет собой sp3-гибрид:
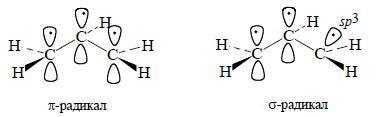
Более стабилен π-радикал, так как в нем возможна делокализация неспаренного электрона. Радикалы могут объединяться перейдя в процессе объединения в σ-радикалы, с образованием 1,5-гексадиена, что реально и происходит в химических реакциях, проводимых с аллильными радикалами:
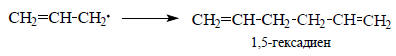
Чтобы объединить два π-радикала с образованием гексатриеновой π-системы, нужно еще и удалить по атому водорода от объединяющихся атомов углерода аллильных радикалов:
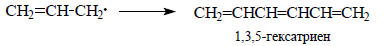
Этот процесс в обычных реакциях не происходит, так как требует затраты энергии на разрыв связей С-Н. Таким образом, объединение двух аллильных фрагментов в гексатриен мы проводим лишь мысленно, не считаясь с затратами энергии на отрыв двух атомов водорода, поскольку нас интересует лишь вопрос: как изменится энергия шестиатомной π-системы по сравнению с двумя трехатомными?
Смотрите также
Разработка основ технологии и оборудования для электрохимического производства нитрата графита
...
Тонкослойная хроматография и ее роль в контроле качества пищевых продуктов
Хроматография,
обязательно включающая процесс разделения смесей веществ в динамическом режиме,
охватывает не только достаточно обширный раздел аналитической химии, но и лежит
в основе ряда ...
Физико-химические методы определения фенола
Аналитическая химия – наука о методах определения химического состава
вещества и его структуры. Однако это определение КС представляется
исчерпывающим. Предметом аналитической химии являются ...


