Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Энергетические составляющие взаимодействия молекулОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Энергетические составляющие взаимодействия молекул Энергетические составляющие взаимодействия молекул
Когда две молекулы или две части одной молекулы вступают в реакцию, происходящее изменение энергии обычно рассматривают как сумму трех вкладов: 1) энергии взаимодействия между занятыми МО; 2) энергии взаимодействия между заполненной орбиталью одного реагента и пустой орбиталью другого реагента; 3) энергии электростатического взаимодействия.Взаимодействие между полностью занятыми орбиталями. В первом приближении (рис. 2.1 и 2.2) взаимодействие между двумя заполненными орбиталями не приводит ни к выигрышу, ни к проигрышу энергии, поскольку понижение энергии при образовании нижней возмущенной орбитали Ψ+ полностью компенсируется при образовании верхней возмущенной орбитали Ψ- и обе эти орбитали заселены электронными парами. Когда же принимается во внимание перекрывание, суммарным эффектом будет повышение энергии, так как |ε+|<|ε-| (рис. 2.3, а). Получается ситуация, аналогичная случаю молекулы Не2 (рис. 17, б в гл. 1). Повышение энергии означает отталкивание между молекулами, и если нет других взаимодействий, способствующих притяжению между молекулами, никакой реакции не произойдет. Если же другие взаимодействия, например, между пустой и занятой орбиталью или чисто кулоновское взаимодействие, помогут преодолеть отталкивание, то реакция все же будет иметь повышенную энергию активации. Обычно когда сравнивают относительную реакционную способность молекул, изменение энергии отталкивания заполненных оболочек не учитывают, считая, что изменение не так велико, как изменение энергий притяжения при переходе от одной молекулы к другой. Это верно лишь в первом приближении, что необходимо всегда иметь в виду.
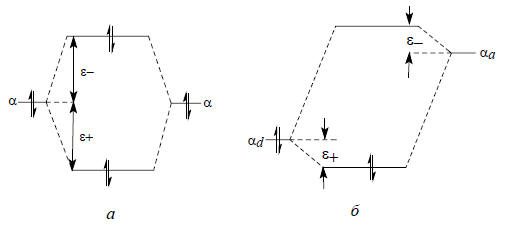 Рис. 2.3. Взаимодействие между двумя заполненными орбиталями приводит к отталкиванию (а), а между заполненной и пустой орбиталями - к притяжению (б).
Рис. 2.3. Взаимодействие между двумя заполненными орбиталями приводит к отталкиванию (а), а между заполненной и пустой орбиталями - к притяжению (б).
Само собой разумеется, что возмущение двух пустых орбиталей не изменяет общей энергии, так как они не имеют материальных носителей энергии - электронов.Взаимодействие между заполненными орбиталями одного реагента и вакантными орбиталями другого реагента. Такое взаимодействие характерно для донорно-акцепторных комплексов. Обычно в этом случае взаимодействующие орбитали сильно отличаются по энергии и поэтому чаще встречается возмущение второго порядка. Если заполненная орбиталь реагирует с пустой орбиталью, то такое взаимодействие приводит к понижению энергии, т.е. к притяжению между реагирующими молекулами (рис. 2.3, б). Энергия занятой орбитали понизится, но соответствующее повышение другой орбитали не будет иметь эффекта, поскольку на ней нет электронов. Энергия стабилизации будет равна 2ε+; множитель 2 возникает из-за того, что возмущаются два электрона. Если взаимодействуют чистые атомные орбитали, то 2ε+=2β2/ΔEα, а если орбиталь не полностью локализована на взаимодействующих атомах d и a, то это учитывается коэффициентами Cd и Ca, вводимыми в уравнение (2.7). В этом случае энергия стабилизации = 2ε+=2(Cd Ca β)2/ΔEα (2.8) где Cd и Ca - коэффициенты, с которыми атомы Cd и Ca входят в молекулярные орбитали, между которыми рассматривается взаимодействие.Электростатическое взаимодействие. Когда реагирующие молекулы представляют собой ионы или диполи, между взаимодействующими атомами будет существовать кулоновское притяжение или отталкивание. Его энергия определяется величиной -qdqa/r, где qd и qa - заряды на взаимодействующих атомах d и а; r - расстояние между атомами (эффективная диэлектрическая проницаемость среды внутри молекулы принимается равной 1).
Смотрите также
Фуллерены
Для химика, основные области интересов
которого - изучение превращений известных веществ и синтез новых, элементарный
углерод - не самое интересное из веществ. Ситуация замечательным образом ...
Обезжелезивание воды
Данное исследование
проводилось в рамках школьного химико-биологического проекта «Многоликое железо».
Проект реализуется в течение учебного
года силами учащихся десятых и одиннадцатых кла ...
Обмен углеводов в организме животного
Углеводы, класс
органических веществ, которые характеризуются тем, что при одной альдегидной
или кетонной группе имеют несколько спиртовых групп (альдегидополиспирты или
кетополиспирты)
...


