Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Водородная связьОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Водородная связь Водородная связь
Если в молекуле содержится гидроксильная группа (например, в спиртах, фенолах, карбоновых кислотах), то атомы кислорода гидроксильных групп двух молекул могут тесно сблизиться из-за образования водородных связей. Водородные связи относятся к числу химических связей средней силы, но, когда их много, они способствуют образованию прочных димерных или полимерных структур. Общеизвестными примерами являются α-спиральная структура дезоксирибонуклеиновой кислоты и других природных полимеров и алмазоподобная структура кристаллического льда. Водородные связи образуются не только между двумя группами -ОН, но и между -ОН и кислородом карбонильной группы С=О, азотом аминогруппы -NH2 и т.д.В гидроксильной группе положительный конец диполя находится у атома водорода, благодаря чему через водород может образовываться связь с анионами или электроотрицательными атомами, имеющими неподеленные пары, например, с атомом кислорода другой молекулы. Почти во всех других полярных группах положительный конец диполя находится внутри молекулы и поэтому трудно доступен для связывания:
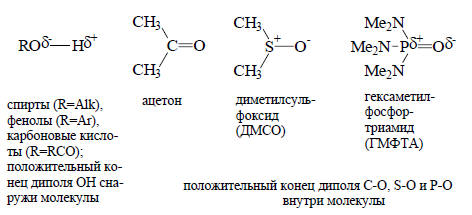
Из-за отсутствия стерических препятствий водородная связь образуется легко. Ее сила определяется тем, что она в значительной степени имеет ковалентный характер, т.е. две пары электронов (связывающие σ-электроны связи О-Н молекулы, являющейся донором водородной связи, и неподеленная пара молекулы акцептора водородной связи) делокализованы между тремя ядрами. Водородная связь обычно изображается пунктирной линией между донором и акцептором, например для случая спиртов:
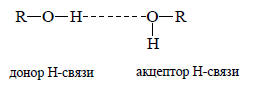
Расстояния между двумя атомами кислорода и водородной связи О-Н .О обычно значительно меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Следовательно, должно быть значительное взаимное отталкивание электронных оболочек атомов кислорода. Однако силы отталкивания преодолеваются силой водородной связи.В общем, сила водородной связи зависит от электроотрицательности связываемых ею атомов. Чем более электроотрицательны атомы, тем более прочная водородная связь образуется ими. Так, очень сильные водородные связи образуются между молекулами H-F. В жидком аммиаке и аминах водородные связи менее прочные, чем в воде и спиртах. Подробнее вопрос о силе водородных связей будет рассмотрен в главе 3 при обсуждении кислот Бренстеда.
Смотрите также
Методы атомно-эмиссионного спектрального анализа
Цель практического эмиссионного спектрального анализа состоит в
качественном обнаружении, в полуколичественном или точном количественном
определении элементов в анализируемом веществе. В зав ...
Атомные и молекулярные орбитали
Молекулы органических соединений образуются из атомов, расположенных в
трехмерном пространстве. Разные атомы образуют разное число связей. Молекулы
имеют определенное пространственное строение, ко ...


