Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Равновесие молекула - димерОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Равновесие молекула - димер Равновесие молекула - димер
В разделе 2.1 указывалось, что в органическом веществе между молекулами на больших расстояниях (в молекулярной шкале) действуют силы притяжения, обусловленные взаимодействием между постоянными диполями полярных связей и (или) индуцированными диполями. Постоянное действие сил притяжения имеет химические последствия. Эти силы способствуют образованию жидкостей и молекулярных кристаллов и увеличивают скорость химических реакций между молекулами.При более тесном сближении молекул начинают действовать силы отталкивания заполненных валентных оболочек; в равновесных условиях наблюдается баланс между силами притяжения и силами отталкивания, и минимальное расстояние, на которое могут сблизиться молекулы (или группы внутри одной молекулы), определяется ван-дер-ваальсовыми радиусами составляющих атомов.Тем не менее в некоторых случаях при конденсации пара в жидкость и твердое тело расстояние между молекулами становится меньше ван-дер-ваальсова. Межмолекулярное расстояние меньше ван-дер-ваальсова означает, что молекулы находятся в химической связи. Образующаяся химическая связь может быть сильной, средней силы или слабой. Например, свежеперегнанный циклопентадиен С5Н6 при хранении быстро превращается в димер С10Н12 в результате реакции циклоприсоединения. Нагревание димера приводит к отгонке первоначального мономерного циклопентадиена. Это означает, что при умеренных температурах существует динамическое равновесие между двумя молекулами циклопентадиена и молекулой димера, т.е. в жидком образце циклопентадиена атомы углерода 1 и 1’ и 4 и 2’ могут сближаться на расстояние, значительно меньшее, чем сумма ван-дер-ваальсовых радиусов.
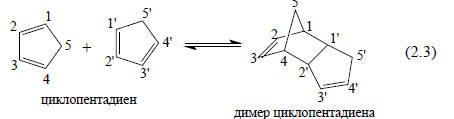
Между атомами 1 и 1’ и 4 и 2’ образуются настоящие прочные ковалентные связи σ-типа.Динамику реакции (2.3) можно описать следующим образом. Когда две молекулы циклопентадиена достаточно удалены друг от друга, между ними действуют силы притяжения. Поскольку молекулы неполярны, притяжение осуществляется за счет слабых взаимодействия, связанных с дисперсионными силами (разд. 2.3). Пусть эти дисперсионные силы привели к образованию молекулярных пар (С5Н6.С5Н6), в которых расстояние между молекулами соответствует ван-дер-ваальсовым радиусам. В определенный момент времени среди этих пар определенная часть устроена так, что атомы 1 и 1’ и 4 и 2’ находятся в ван-дер-ваальсовом контакте. Тогда некоторые из этих благоприятно ориентированных пар молекул будут иметь энергию, достаточную для преодоления энергетического барьера, и произойдет реакция (2.3). Непрореагировавшие пары молекул вследствие теплового движения могут распасться, снова дать новые пары, часть которых будет благоприятно ориентирована, степень димеризации все время будет увеличиваться, но некоторые молекулы димера будут вновь распадаться на мономерные молекулы. Таким образом, установится положение равновесия, соответствующее температуре образца.
Смотрите также
имическая сборка поверхности твердых тел путем молекулярного наслаивания
Получение принципиально новых характеристик
материалов и изделий, особенно при создании искусственных структур, основанных
на квантовых эффектах [1-6], невозможно в перспективе без создания ...
Исследование свойств продуктов циклизации алициклического 1,5,9-трикетона
Алициклические
1,5,9-трикетоны – малоизученный класс соединений, хотя первые сведения о них
появились еще в 50-х годах прошлого века. Наличие нескольких реакционных
центров делают трикетоны ...


