Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Постоянный дипольный моментОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Постоянный дипольный момент Постоянный дипольный момент
Если два заряда (+q) и (-q) разделены расстоянием R, то они образуют диполь величиной qR. Например, в молекуле метилфторида CH3F у атома фтора имеется частичный, т.е. меньше единичного электронного заряда, отрицательный заряд, а у атома углерода (точнее, в электростатическом центре группы СН3) - такой же по абсолютной величине положительный заряд. Значит, молекула CH3F будет иметь дипольный момент, величина которого определяется полярностью и длиной связи C-F. Кроме величины диполь имеет направление, и условно принято считать, что он направлен от отрицательно заряженного конца к положительному.
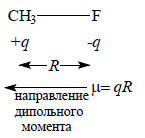
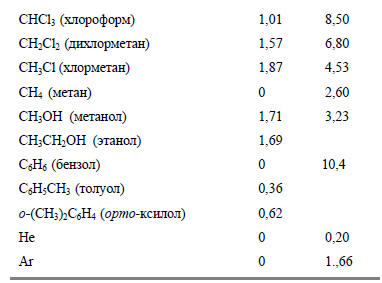
Дипольные моменты (μ) обычно выражают в Дебаях (Д), причем 1Д=3.336.10-3 Кл.м.Значения дипольных моментов дают информацию о строении молекул и, кроме того, часто используются для проверки того, насколько верно вычислены молекулярные орбитали. На практике знание величин дипольных моментов необходимо, например, для подбора подходящего растворителя для данного твердого вещества, так как способность растворителя разрушать ионные кристаллы связана с его способностью сольватировать ионы и уменьшать электростатическое взаимодействие, удерживающее ионы в кристалле. Роль полярных молекул растворителя двойная. Во-первых, один конец диполя молекулы растворителя может электростатически притягиваться к иону противоположного знака, и это уменьшает энергию иона. Во-вторых, в растворе уменьшается сила кулоновского взаимодействия между ионами. Это достигается следующим образом. Когда два иона находятся в вакууме на расстоянии R друг от друга, потенциальная энергия их взаимодействия пропорциональна ε0R, где ε0 - диэлектрическая проницаемость вакуума (8.854.10-12 Дж-1.Кл2.м-1); однако, когда они помещены в растворитель, энергия уменьшается до 1/4πε0εR, где ε - относительная (если принять ε0 за единицу) диэлектрическая проницаемость растворителя. Величина ε частично определяется дипольным моментом растворителя, и может оказать большое влияние на силу кулоновского взаимодействия. Например, вода имеет ε=78; это значит, что кулоновское взаимодействие в воде уменьшается почти на два порядка по сравнению с вакуумом.Точную величину дипольного момента измеряют при исследовании вращательных спектров молекул в газовой фазе по сдвигу линий в сильном электрическом поле (эффект Штарка). Если же молекула очень сложна, нелетучая или нестабильна в газовой фазе, то измерение обычно основано на определении относительной диэлектрической проницаемости ε образца в массе. Величины дипольных моментов для некоторых молекул приведены в табл. 2.1.

Смотрите также
Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii
...
Разделение урана и тория с помощью тонкослойных неорганических сорбентов
Цель работы:
Концентрирование микроколичеств тория из
водного раствора соли уранила.
Уран и торий являются наиболее
распространенными природными радиоактивными элементами. Три естестве ...
Методика проведения потенциометрического титрования.
Рассмотрим процесс
потенциометрического титрования сильной кислоты раствором сильной щелочи. ...


