Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Основные представлени о методах расчета молекулярных орбиталей. Метод
ХюккеляОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Основные представлени о методах расчета молекулярных орбиталей. Метод
Хюккеля Основные представлени о методах расчета молекулярных орбиталей. Метод
ХюккеляСтраница 3
После всего сказанного очевидно, что в методе МОХ используется так много сомнительных предположений, что он не может давать хорошие результаты. Тем не менее это не так: для чисто углеродных π-систем рассчитанные свойства очень хорошо согласуются с экспериментом. Исследования, проведенные М.Дьюаром, показали, что этот факт обусловлен удачным взаимным сокращением ошибок, а также характером молекул, к которым этот метод применим (сопряженные π-системы).
Используя предположения Хюккеля, для аллильной π-системы из уравнений (1.8) и (1.9) получаем
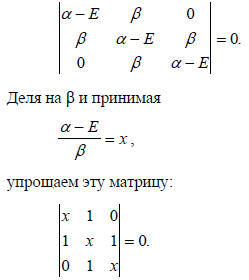
Далее этот детерминант разбиваем на (2х2)-детерминанты путем суммирования произведений каждого члена верхнего ряда на множитель, который определяется правилом: множитель j-го члена есть детерминант, полученный путем удаления j-й колонки и верхнего ряда матрицы:
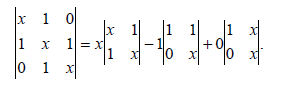
Заметим, что четные члены при разбиении матрицы всегда должны быть отрицательны. Детерминант типа (2х2) решаются простым перекрестным умножением и вычитанием произведений:
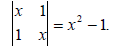
В результате получаем уравнение
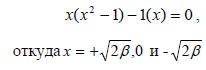
Таким образом, энергии аллильных π-орбиталей, измеренные относительно несвязывающего уровня α, будут иметь значения 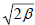 , 0 и
, 0 и 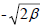 , т.е. 1.41β, 0 и -1.41β. Отметим, что эти энергии очень близки к величинам, рассчитанным методом возмущений (1.5; 0 и -1.5; см. рис. 2.11 в гл.2).
, т.е. 1.41β, 0 и -1.41β. Отметим, что эти энергии очень близки к величинам, рассчитанным методом возмущений (1.5; 0 и -1.5; см. рис. 2.11 в гл.2).
Общая энергия π-электронов аллильной системы определяется выражением
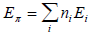
где ni = число элетронов на орбитали i. Следовательно,
где множитель 2 соответствует двум электронам на данной орбитали. Напомним, что α и β - отрицательные величины.
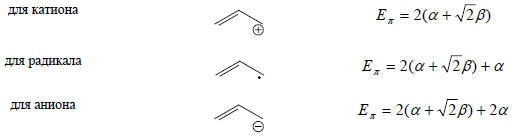
Энергию стабилизации (ΔЕπ) в результате сопряжения можно оценить сравнением с энергией локализованной системы с помощью уравнения
Елок=nπ(α+β)+niα,
где nπ - число электронов на двойных свяях (для аллильной системы nπ = 2), а ni - число неподеленных электронов (для аллильного катиона - 0, для радикала - 1, для аниона - 2). Таким образом, для всех трех частиц - катиона, радикала и аниона -
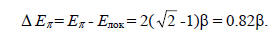
Коэффициенты можно определить подстановкой соответствующих значений Е в вариационное уравнение с применением условия нормировки
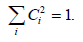
Для аллильной системы вариационные уравнения имеют вид
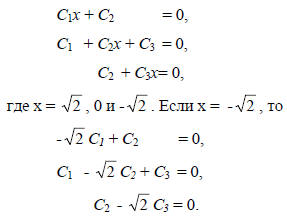
Из первого уравнения
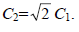
Подстановкой во второе уравнение получим
С1 = С3.
Условие нормировки дает
Следовательно, 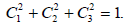
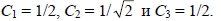
Таким образом, нижняя орбиталь аллильной π-системы имеет вид
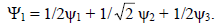
Решения для 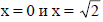 дают две другие аллильные π-орбитали.
дают две другие аллильные π-орбитали.
Смотрите также
Исследования электролитов кадмирования
Cd - довольно мягкий металл серебристо-белого
цвета несколько тверже олова но мягче цинка , вальцуется в листы , хорошо
куется и легко поддается полированию. Чистый ,свободный от по ...
Биоразлагаемые полимерные материалы
В последние годы,
как в нашей стране, так и за рубежом возрос интерес к биоразлагаемым полимерным
материалам и упаковкам из них, которые разрушаются при воздействии различных
микроорганизмо ...


