Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гибридизация и форма многоатомных молекул. ГибридизацияОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Гибридизация и форма многоатомных молекул. Гибридизация Гибридизация и форма многоатомных молекул. ГибридизацияСтраница 1
В случае гомоядерных молекул мы проводили комбинацию АО, пользуясь правилом, согласно которому наиболее сильно взаимодействуют орбитали одинаковой энергии. В гетероядерных молекулах типа АВ энергетические уровни атомов А и В неодинаковы, поэтому трудно однозначно утверждать, какие орбитали будут комбинироаться. Для случая LiH это показано на рис. 1.11.
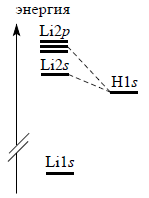
Рис. 1.11. Энергетические уровни АО Li и Н.
Хотя уровень Li2s лежит ближе к H1s, но не так далек и уровень Li2p. Поэтому вряд ли справедливо рассматривать только связь H1s-Li2s. Лучше получается, если взять линейную комбинацию всех трех орбиталей:
ψ=С1(Li2s)+С2(Li2p)+С3(H1s)
Смысл этого уравнения графически можно выразить следующим образом. Молекула Li-H полярная, так как атомы Li и Н отличаются по электроотрицательности. Следовательно, плотность связывающей σ-орбитали связи Li-Н будет больше на атоме водорода. Другими словами, связывающая σ-орбиталь по энергии и по форме более похожа на 1s-орбиталь водорода, а 2s- и 2р-орбитали лития имеют относительно небольшие коэффициенты в линейной комбинации, что указывается помещением этих орбиталей в скобки:
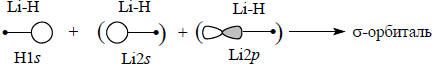
Чтобы построить σ-орбиталь, можно сначала сгруппировать две орбитали лития в две гибридные орбитали Lih1 и Lih2, имеющие форму несимметричной гантели, из-за того что при наложении сферическим симметрической s-орбитали на гантелеобразную р-орбиталь с одной стороны узловой плоскости р-орбитали волновые функции интерферируют положительно, а с другой стороны - отрицательно.
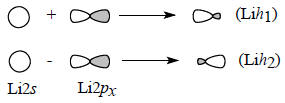
Далее можно считать, что одна связь образуется в результате перекрывания H1s с одной из гибридных орбиталей, т.е.
ψ=C1(Li, гибридная) + С2(H1s).
Очевидно, что связывание будет осуществляться орбиталью Lih2, бóльшая доля которой направлена в сторону атома Н:
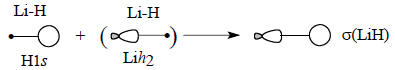
Аналогично, антисвязывающая σ*-орбиталь связи Li-Н может быть построена из гибридной орбитали лития и 1s-орбитали водорода. Для этого используется орбиталь Lih1, меньшая доля которой направлена в сторону атома Н. Это выгоднее, чем ситуация, когда в сторону атома водорода направлена бóльшая доля гибридной орбитали, так как в первом случае перекрывание будет меньше и «антисвязь» будет слабее.
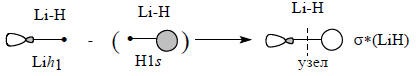
Отметим, что в орбиталь σ* главный вклад вносят орбитали лития, что отражена на схеме относительными размерами АО.
Представлениями о гибридных АО в органической химии пользуются очень широко, поскольку при этом сохраняется главная и самая привлекательная особенность теории МО: связь между двумя атомами образуется взаимодействием только двух, а не трех АО. Так за счет усложнения удается сохранить простоту теории МО. Введение понятия гибридизации не обусловлено ни математической, ни физической необходимостью, а продиктовано лишь желанием найти наиболее простое описание связи.
Смотрите также
Выводы.
1. Для осаждения препарата
протеиназы целесообразно применять этанол или изопропанол.
2. Компонентный состав препарата
представлен четырьмя фракция ...
Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Проблема очистки воды для хозяйственно - питьевых нужд от
токсикантов, в частности, от соединений тяжелых металлов, является весьма
актуальной природоохранной проблемой в Тульском регионе, в ...
Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра
Спирты представляют собой соединения
общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному
атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, ...


