Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гомоядерные двухатомные молекулыОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Гомоядерные двухатомные молекулы Гомоядерные двухатомные молекулыСтраница 1
В разделе 1.4.3 было показано, каким образом на основе водородных атомных орбиталей можно объяснить строение двухатомных атомов. Точно так же поступают и при объяснении структуры двухатомных молекул. Сначала, основываясь на МО иона Н2+., определяют МО другой двухатомной молекулы, а затем, пользуясь принципом Паули, заселяют эти МО необходимым числом электронов. Рассмотрим электронное строение простых двухатомных молекул, сначала гомоатомных типа Х2, а затем гетероатомных типа XY.
Молекула Н2. В случае молекулярного водорода указанная процедура очень проста: нужно разместить два электрона на орбиталях 1sσ и 1sσ*. Энергия будет минимальна, если оба электрона займут связывающую орбиталь (рис. 1.7, а). Это соответствует конфигурации 1sσ2. Поскольку два электрона занимают одну и ту же МО, они должны иметь противоположные спины. Следовательно, в основном электронном состоянии молекулы водорода связь осуществляется парой электронов. Следует подчеркнуть, что химическая связь возникает не в результате спаривания спинов, а в результате прекрывания атомных волновых функций. Смысл спаривания спинов заключается не в важности самого факта спаривания, а в том, что путем спаривания можно достичь наиболее выгодного размещения электронов в пространстве, так что оба они будут находиться в межъядерной области, «не мешая» друг другу*. В этом и состоит роль электронных пар в теории валентности.
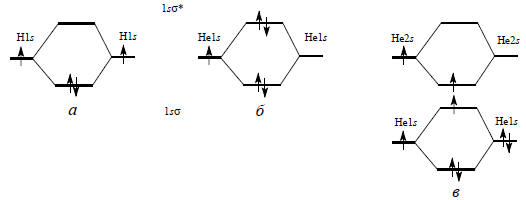
Рис. 1.7. Электронное строение Н2 (а), Не2 (б) и Не .Не* (в)
Молекула Не2. Теперь можно понять, почему молекула Не2 нестабильна. Молекулярные орбитали 1sσ и 1sσ* образуются путем перекрывания 1s-орбиталей двух атомов гелия. Молекула имеет четыре электрона, следовательно, два из них с антипараллельными спинами можно поместить на 1sσ-МО. Следующий электрон нельзя поместить на эту орбиталь, так как будет нарушен принцип Паули, и поэтому он занимает 1sσ*-орбиталь (см. рис. 1.7,б). Это приводит к ослаблению (разрыхлению) связи, образованной первой электронной парой. Четвертый электрон с противоположным спином занимает также 1sσ*-орбиталь. Молекула Не2 имеет одну связь и одну «антисвязь», которые взаимно уничтожают друг друга. На самом деле антисвязь по эффекту превосходит связь, т.е. разрыхляющая орбиталь более разрыхляет, чем связывающая связывает, и это приводит к тому, что молекула Не2 менее стабильна, чем два отдельных атома гелия.
Но пусть один из атомов гелия возбужден в более высокое состояние (например, 1s-электрон промотирован на 2s-орбиталь). Тогда только что приведенные аргументы становятся нейдействительными, так как образующаяся молекула будет иметь конфигурацию 1sσ21sσ*2sσ, где 2sσ -это орбиталь, образованная из 2s -орбиталей. Теперь разрыхляющего эффекта одного 1sσ*-электрона будет недостаточно, чтобы преодолеть связывающий эффект 1sσ2 (рис. 1.7,в), и поэтому молекула Не .Не* будет существовать, пока не потеряет энергию возбуждения путем излучения или в результате столкновения. Подобные слабо связанные возбужденные димеры (эксимеры) для благородных газов известны.
2рσ-и 2рπ-Орбитали. У элементов второго периода 1s-обитали сильно «поджаты» к ядру (разд. 1.4.2), и поэтому они перекрываются у двух соседних атомов молекулы лишь в слабой степени, т.е. вносят малый вклад в энергию связывания. 2s-Обитали гораздо больше и перекрываются намного эффективнее, поэтому их роль в энергии двухатомных молекул второго периода очень значительна. Однако кроме 2s-орбиталей могут перекрываться и 2р-орбитали. Такое перекрывание имеет ряд характерных особенностей.
Если перекрываются две 2р-орбитали, направленные вдоль межъядерной оси, то это может привести к положительной интерференции и накоплению электронной плотности в межъядерной области (рис. 1.8,а). Они могут также проинтерферировать деструктивно, тогда возникает узловая плоскость, проходящая через середину межъядерного расстояния. В первом случае образуется сильно связывающая МО, а во втором - сильно разрыхляющая МО. Поскольку обе эти орбитали имеют цилиндрическую симметрию относительно межъядерной оси, их обозначают как 2рσ- и 2рσ*-МО.
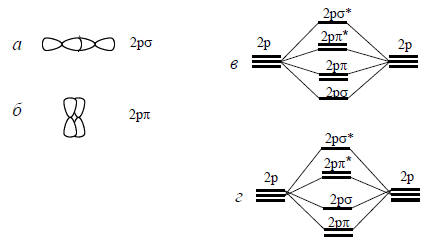
Рис. 1.8. Образование 2рσ-МО (а) и 2рσ*-МО (б); в - предсказанное расположение по энергии, г - часто наблюдаемая последовательность.
Однако 2р-орбитали могут перекрываться и по-другому, так что увеличение электронной плотности при перекрывании в фазе или узел при перекрывании в противофазе наблюдаются хотя и в межъядерной области, но не на самой межъядерной оси (боковое перекрывание, рис. 1.8,б). Когда МО образуется боковым перекрыванием р-орбиталей, она называется π-орбиталью. Связывающая и разрыхляющая комбинации называются соответственно 2рπ- и 2рπ*-орбиталями. Обе эти МО слабее, чем σ-орбитали, поскольку накопление электронной плотности происходит вдали от оптимальных положений. Поэтому в принципе положение их по энергии должно быть таким, как показано на рис. 1.8,в. На самом же деле относительное положение 2рσ- и 2рπ-орбиталей меняется в зависимости от природы молекулы вследствие влияния электрон-электронных взаимодействий. Часто более приемлемой картиной является изображенная на рис. 1.8,г. Точную последовательность энергетических уровней получают или путем расчета, или с помощью разных видов спектроскопии.
Смотрите также
Простейшая схема одноэлектронной теории
...
Алифатические амины. Ароматические амины
Химические свойства аминов ...
Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров
...


