Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Атомные орбитали. Орбитали атома вододрода.Органическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Атомные орбитали. Орбитали атома вододрода. Атомные орбитали. Орбитали атома вододрода.Страница 2
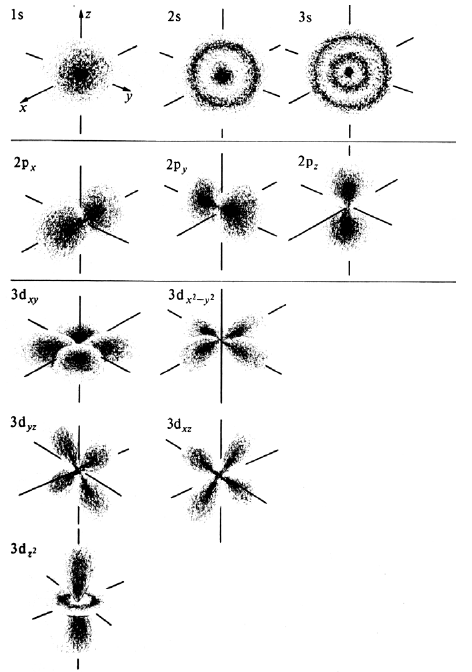
Рис. 1.1. Распределение плотности некоторых атомных орбиталей атома водорода в пространстве.
Все орбитали с нулевым угловым моментом называются s-орбиталями. s-Орбиталь низшей энергии (n=1, l=0, m=0) называется 1s-орбиталью. Если n=2 и l=0, то это 2s-орбиталь. Ее энергия выше, чем энергия 1s-орбитали, по двум причинам. Во-первых, она имеет радиальный узел (рис. 1.2), представляющий собой сферическую поверхность, внутри и снаружи которой волновая функция имеет разные знаки, и на самой этой поверхности электронная плотность равна нулю. Появление узлов на любой орбитали повышает энергию электрона, занимающиего эту орбиталь, и чем больше узлов, тем энергия орбитали выше. аренда столов
Это связано с тем, что с увеличением числа узлов длина волны электрона становится короче, т.е. большее число полуволн приходится на одну и ту же область пространства и поэтому его кинетическая энергия возрастает. Во-вторых, повышение энергии 2s-орбитали по сравнению с 1s-орбиталью связано с тем, что 2s-орбиталь простирается на расстояние, более далекое от ядра, и поэтому потенциальная энергия электрона на ней выше, чем на 1s-орбитали. Аналогичные замечания можно сделать и относительно более высоко лежащих s-орбиталей: 3s, 4s и т.д.
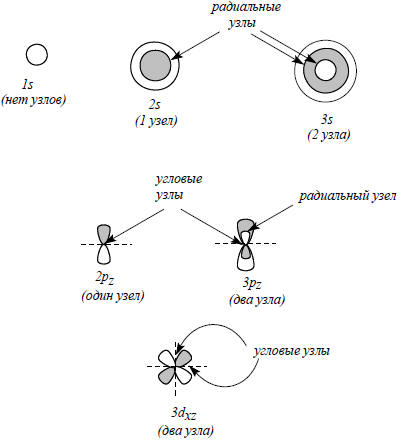
Рис. 1.2. Узловые свойства и симметрия атомных орбиталей. Орбиталь с n=1 не имеет узлов. Орбитали с n=2 имеют один узел, с n=3 - два узла и т.д. Относительно операции симметрии инверсии (центр инверсии совпадает с центром ядра) все s-орбитали симметричны, все р-орбитали антисимметричны, все d-орбитали симметричны и т.д.
Если n=0, единственным значением, разрешенным для l, является нуль, но если n=2, квантовое число орбитального углового момента может принимать значения 0 (2s-орбиталь) или 1. Если l=1, атомные орбитали носят название р-орбиталей. При n=2 и l=1 мы имеем 2р-орбиталь. Она отличается от 2s-орбитали тем, что занимающий ее электрон обладает орбитальным угловым моменто величиной (2)1/2ђ. Угловой момент является следствием наличия углового узла (рис. 1.2), который, как говорят, «вводит кривизну в угловое изменение волновой функции» (шар превращается в гантель). Наличие орбитального углового момента оказывает сильное влияние на радиальную форму орбитали. В то время как все s-орбитали у ядра имеют ненулевое значение, р-орбитали там отсутствуют. Это можно представить как отбрасывание электрона от ядра орбитальным угловым моментом. Сила кулоновского притяжения электрона к ядру пропорциональна 1/r2 где r - расстояние от ядра, а центробежная сила, отталкивающая электроны от ядра, пропорциональна J2/r3 (J - угловой момент). Поэтому, если угловой момент J≠0, при очень малых r центробежная сила превосходит кулоновскую. Этот центробежный эффект проявляется также в АО с l=2, которые называются d-орбиталями, l=3 (f-орбитали) и более высоких орбиталях (g-, h-, j-орбитали). Все эти орбитали, из-за того, что l≠0, имеют нулевую амплитуду у ядра и, следовательно, вероятность обнаружить там электроны равна нулю.
У 2р-орбитали нет радиального узла, но зато 3р-орбиталь его имеет. Эскизы нижних атомных орбиталей, иллюстрирующие свойства и симметрию АО (но не вероятностное распределение электрона внутри орбитали, как на рис. 1.1), приведены на рис. 1.2. Светлые и затемненные области - это места, где волновая функция имеет разные знаки. Поскольку выбор знака произволен, безразлично, будем ли мы соотносить затемненные области с положительным, а светлые области с отрицательным знаком волновой функции, или наоборот. Граница между светлой и темной областями орбиталей - это узел, т.е. то место, где волновая функция равна нулю, или, другими словами, место, где волновая функция меняет знак на противоположный. Чем больше узлов, тем выше энергия электрона, занимающего данную АО.
Поскольку для р-орбиталей l=0, квантовое число m может принимать значения +1, 0 и -1. Разные значения m соответствуют орбиталям с различными ориентациями орбитального углового момента. р-Орбиталь с m=0 имеет нулевую проекцию углового момента на ось z (рис. 1.2), и по этой причине ее называют pz-орбиталью. Вид pz -орбитали (см. рис. 1.1 и 1.2) говорит о том, что электронная плотность «собрана в заводи» вдоль оси z. В этом случае существует горизонтальная узловая плоскость, проходящая через ядро, и вероятность найти электрон в этой плоскости равна нулю. Две другие р-орбитали можно представить аналогичными картинами с ориентацией «лопастей» вдоль осей x и y (см. рис. 1.1), поэтому они называются px и py-орбиталями.
Смотрите также
Вычисление теплового эффекта реакций
Вычислить тепловой эффект реакции при стандартных
условиях: Fe2O3 (т) + 3 CO (г)
= 2 Fe (т) + 3 CO2 (г),если теплота образования: Fe2O3
(т) = – 821,3 кДж/моль;СО(г) = – 110,5 кДж/моль;
...
Нефть, ее свойства
Бурный научно-технический прогресс и высокие темпы развития
различных отраслей науки и мирового хозяйства в XIX – XX вв. привели к резкому
увеличению потребления различных полезных ископ ...


