Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Энергетика реакцийCправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Cправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Энергетика реакций Энергетика реакций
Любая реакция сопровождается выделением или поглощением энергии в форме теплоты. В исходных веществах химические связи разрываются, и на это энергия затрачивается (т. е. она при этом поглощается системой), в продуктах же, наоборот, химические связи образуются, и при этом энергия выделяется. Разность между затраченной и выделившейся энергией называется тепловым эффектом химической реакции (обозначается Q). Если затрата энергии выше, чем ее выделение, то тепловой эффект будет отрицательным
, или эндо‑эффектом (‑Q) в противном случае – положительным
, или экзо‑эффектом (+Q).
Тепловой эффект является внешним признаком реакций, в термохимических уравнениях он указывается после продуктов:
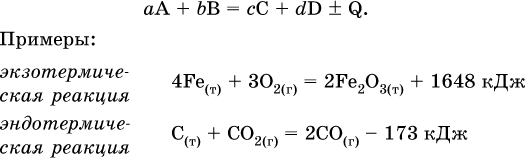
Такая запись означает, что при сгорании 4 моль железа в 3 моль кислорода с образованием 2 моль оксида железа (III) выделяется 1648 кДж теплоты, а при взаимодействии 1 моль углерода (в виде кокса) и 1 моль углекислого газа с получением 2 моль угарного газа поглощается извне 173 кДж теплоты.
Тепловые эффекты прямой
и обратнойреакций одинаковы по числу, но противоположны по знаку. Например, реакция
![]()
(обработка 1 моль оксида кальция водяным паром в количестве 1 моль с образованием 1 моль гидроксида кальция) сопровождается экзо‑эффектом Q = +108 кДж, тогда как обратная реакция
![]()
(разложение 1 моль гидроксида кальция на 1 моль оксида кальция и 1 моль водяного пара) сопровождается эндо‑эффектом Q = ‑108 кДж.
При протекании реакций (особенно с участием газов
) могут существенно меняться объем и температура реакционной системы. Если тепловой эффект определяется при постоянном давлении (1 атм для каждого газа в системе, а при отсутствии газов общее давление 1 атм) и постоянной температуре (обычно 298 К, или 25 °C), то он отвечает стандартной энтальпии реакции, характеризующей в целом всю систему (функция системы). Энтальпия реакции обозначается ΔН°, знак ΔН° противоположен знаку Q:
![]()
Значение ΔН° записывается после уравнения и отделяется от него запятой:
![]()
Реакции, протекающие с высоким экзо‑эффектом, часто требуют только начального нагревания (инициирования), а далее протекают самопроизвольно, например процесс алюминотермии:
![]()
Помимо энтальпии, химическая система характеризуется еще одной функцией – стандартной энтропией реакции ΔS° (кДж/К), связанной с неупорядоченностью системы (степенью беспорядка). Чем больше частиц в системе и чем выше ее температура, тем больше степень беспорядка. В идеальном кристалле (при абсолютном нуле температуры) степень беспорядка нулевая (идеальный порядок), в реальных твердых телах существует всегда некоторая степень беспорядка, в жидкостях она уже выше, но наибольшая степень беспорядка в газах, где молекулы не зависят друг от друга и двигаются весьма хаотично. Например, для льда, жидкой воды и водяного пара значения ΔS° равны соответственно 0,039, 0,07 и 0,189 кДж/К.
Всякая химическая реакция, таким образом, имеет две энергетические характеристики – энтальпию ΔН° и энтропию ΔS°. Для самопроизвольных реакций характерно стремление к уменьшению
энергии за счет теплопередачи в окружающую среду и одновременно к увеличениюстепени беспорядка. Эти факторы действуют в противоположных направлениях, поэтому результирующая величина будет равна их разности:
![]()
(здесь энтропия умножена на температуру для адекватности единиц, ΔН° и TΔS° приведены в килоджоулях, так как К кДж/К = кДж).
Суммарная энергетическая функция системы называется стандартной энергией Гиббса реакции ΔG°T, индекс Т подчеркивает зависимость этой величины от температуры, что очевидно из уравнения (отметим еще, что ΔН° и ΔS° мало зависят от температуры).
По значениям G°T можно судить о возможности протекания реакций в направлении слева направо по химическому уравнению:
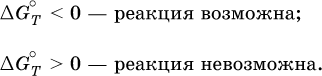
Например, синтез аммиака
![]()
при 25 °C возможен:
![]()
а при 350 °C невозможен:
![]()
Следовательно, при 25 °C имеется принципиальная возможность получения аммиака, а при сильном нагревании системы (реакция экзотермическая, ΔН° = ‑92 кДж) аммиак получить не удастся. Правда, при 25 °C реакция возможна только в принципе, так как она протекает очень медленно и с малым выходом. Ускорение реакций определяется факторами химической кинетики, а увеличение степени протекания – соответствующим смещением химического равновесия.
Смотрите также
Занимательные опыты по химии
...
Ультрафиолетовое отверждение лаков и красок
На сегодняшний
момент в различных областях науки и промышленности ведутся активные
исследования, направленные на создание ресурсо- и энергосберегающих
экологически безопасных технологий. В ...


