Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Современный этап изучения колебательных режимовСтатьи и работы по химии / Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования / Литературный обзор / Статьи и работы по химии / Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования / Литературный обзор / Современный этап изучения колебательных режимов Современный этап изучения колебательных режимовСтраница 1
В настоящее время кинетика колебательных реакций - бурно развивающаяся отрасль знаний, возникшая на стыке химии, биологии, медицины, физики, математики. В настоящее время показано, что хаотические режимы наблюдаются во многих областях биологии (в биохимии, биофизике, учении о биоритмах, при изучении динамики популяций, миграции организмов и т.д.), экологии и в самом широком понимании этого понятия некоторых социальных процессах (изменение народонаселения, развитие экономики). Детальное изучение взаимодействия колебаний, распространяющихся от двух пространственно удаленных центров, помогло разобраться в различных видах аритмий, возникающих в сердечной мышце [12]. Во многих случаях сравнительно простые динамические химические системы со строго контролируемыми концентрационными изменениями исходных и промежуточных химических веществ могут оказаться весьма подходящими функциональными моделями при изучении хаотических процессов в других областях знаний (науке о Земле и других планетах, физике твердого тела, ядерной физике и физике элементарных частиц, инженерной механике и т.д.).
Влияние физических и химических факторов на систему Белоусова-Жаботинского также занимает важное место в современных исследованиях.
В 1974 году профессором химии и биологии Аризонского университета (США) Артуром Т. Уинфри [13] были открыты пространственно-временные структуры в неперемешиваемой системе Белоусова-Жаботинского, возникающие и существующие в виде различных двух- и трехмерных пространственных рисунков (например, концентрических колец, спиралей, волновых фронтов и т.п.). С тех пор интерес к системам без перемешивания постоянно растет и в последнее время в большой мере не остается только академическим, но и указывает на перспективность исследований в данном направлении. Большинство широко исследованных колебательных химических реакций – реакции Белоусова – Жаботинского. В этих реакциях органические субстраты окисляются броматными ионами в серной кислоте в присутствии метал-ионов катализатора. В 1987 году в лаборатории физической химии в Университете Юнтедо (Япония) были найдены органические субстраты, производящие двойную частоту колебаний реакции Белоусова – Жаботинского [20]. В опытах с использованием одного из четырех органических субстратов, среди них метиловый эфир ацетоуксусной кислоты и этиловый эфир 4-хлорацетоуксусной кислоты, наблюдали эффект колебаний двойной частоты.
Еще одним новым направлением научных исследований является изучение особенностей самой реакции Белоусова- Жаботинского или сходных с ней (Бриггса-Раушера, Брея-Либавски и т.п.).
Например,
ранее реакцию Белоусова проводили в закрытом реакционном сосуде, поэтому из-за расходования реагентов (бромата и малоновой кислоты) колебания затухали. Затем в проточном реакторе непрерывного перемешивания получили незатухающие колебания [21], что позволило изучать тонкие стороны механизма автоколебаний, в частности зависимость периода и амплитуды колебаний от интенсивности ультрафиолетового излучения. В таком реакторе был зарегистрирован и режим прерывистой генерации. 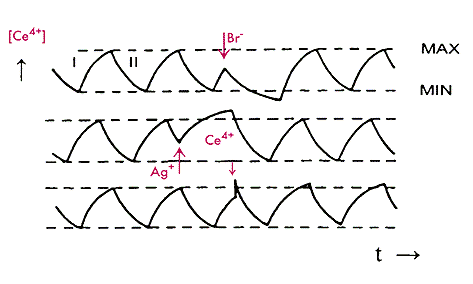 Рис.2.3.3 Автоколебания концентрации церия и принудительная смена стадий I и II, вызываемая добавкой Br-, Ag+ и Ce4+.
Рис.2.3.3 Автоколебания концентрации церия и принудительная смена стадий I и II, вызываемая добавкой Br-, Ag+ и Ce4+.
В системе имеется некоторая концентрация Ce4+. На стадии II образуется Br-, который после взаимодействия с активными частицами реакции окисления Ce3+ исчезает из системы. При достаточно большой концентрации Br- окисление полностью заторможено. Когда концентрация Ce4+ уменьшается и достигает минимального значения, резко падает концентрация Br-. Окисление Ce3+ (I стадия) начинается с большой скоростью, и концентрация Ce4+ возрастает; когда она достигает максимального значения, увеличивается концентрация Br-, что тормозит окисление Ce3+. После этого цикл повторяется. Одновременно измеряя концентрацию йода спектрофотометрически и потенциал йодсеребряного электрода (концентрацию I-), получается классическая картина разрывного предельного цикла в периодической реакции Брея, когда в системе концентрация I2 служит медленной переменной, а концентрация I- - быстрой. Используя спектрофотометрическую запись (Ce4+) одновременно с записью потенциала бромсеребряного электрода (Br-), можно увидеть достаточно сложные фазовые портреты.
В Ивановском Институте растворов РАН в 2001 г. были проведены экспериментальные исследования динамических свойств плазмы в условиях инициирования гетерогенных химических реакций. Было доказано, что химически реагирующая плазма при пониженном давлении проявляет колебательный динамический режим, который влияет на линейный выход продуктов. Можно полагать, что многие известные в настоящее время “гладкопротекающие” сложные реакции могут проходить при определенных концентрационных и температурных условиях в колебательном режиме. В табл.2.3.3. приведены некоторые из найденных гомогенных колебательных окислительно-восстановительных процессов.
Смотрите также
Химические свойства и область применения полиэтилентерефталата
Полиэтилентерефталат
(ПЭТФ, ПЭТ)- термопластик, наиболее распространённый
представитель класса полиэфиров, известен под разными фирменными названиями:
полиэфир, лавсан или полиэстер.
Пла ...
Реакции фенолов
Фенолы могут реагировать как
по гидроксильной группе, так и по бензольному кольцу.
...
Основы метода потенциометрического
титрования.
Рассмотрим основные
понятия потенциометрического титрования, его виды и методы проведения, способы установления
точки эквивалентности при титровании. ...


